La Dra. Leonor Pérez Martínez es profesora e investigadora del Instituto de Biotecnología de la UNAM. Bióloga por la UNAM, con maestría en el Instituto Weizmann (Israel) y doctorado en el Instituto Friedrich Miescher (Suiza), realizó un posdoctorado en neurociencias en la Universidad de Vermont (USA). Es integrante de la Academia de Ciencias de Morelos.
El Dr. Gustavo Pedraza Alva es investigador del Instituto de Biotecnología de la UNAM. Biólogo por la UNAM, con maestría en el Instituto Weizmann (Israel) y doctorado en el Instituto Friedrich Miescher (Suiza), realizó un posdoctorado en inmunología en la Universidad de Vermont (USA).
Esta publicación fue revisada por el comité editorial de la Academia de Ciencias de Morelos.
El pasado 6 de octubre se anunciaron los ganadores del Premio Nobel 2025 en Fisiología o Medicina. El premio será otorgado a Mary E. Brunkow, Fred Ramsdell y Shimon Sakaguchi, “por sus descubrimientos acerca de la tolerancia inmune periférica”. El terso anuncio de la Fundación Nobel no hace justicia a una historia científica fascinante, que combina el hallazgo de un fenómeno crucial para la protección de todos los mamíferos contra enfermedades y toxinas, pero evitando atacar nuestros propios componentes. Pocas historias en biomedicina combinan tanta controversia, paciencia y reinvención como la que motiva este Premio Nobel. Y también pocas tendrán consecuencias tan importantes para la salud humana. Vamos a hablar acerca de ello.
El sistema inmune, nuestro gran protector
La vida es difícil, lo sabemos. Y es más difícil cuando todos los días estamos expuestos a microbios que producen enfermedades, toxinas que afectan a nuestro cuerpo y aún a células cancerosas con efectos potencialmente mortales. Afortunadamente, la evolución nos ha dotado de un formidable sistema de protección, el sistema inmune, el cual es el principal protector contra estas agresiones. Muy simplificadamente, el sistema inmune está compuesto, entre distintas células, por linfocitos B que producen anticuerpos, sustancias que pueden atacar muy específicamente a toxinas, microbios y virus y neutralizarlas. El sistema inmune contiene también células, conocidas como linfocitos T, que pueden cubrir varias funciones, como promover la destrucción de microbios y atacar directamente a células infectadas con virus o células tumorales, pero también estimular la multiplicación, cuando es necesario, de las células productoras de anticuerpos. Podríamos pensar, equivocadamente, que los medicamentos son nuestros principales protectores. En realidad, los medicamentos nos dan tiempo y reducen la abundancia de nuestros atacantes, pero es nuestro sistema inmune el que hace la mayor parte de la tarea. Sin él, nuestra vida sería muy corta y llena de sufrimientos.
Pero un sistema de defensa tan eficiente también tiene que controlarse. Tiene que poder distinguir entre “lo propio” y lo que hay que atacar, característica conocida como tolerancia inmunológica. Sin tolerancia, nos autolesionaríamos; con demasiada tolerancia, dejaríamos pasar infecciones y tumores. Es un equilibrio fino. Hacia finales del siglo XX sabíamos mucho acerca del sistema de defensa, pero poco acerca de qué sistema era responsable de la tolerancia. ¿Qué sistema evita que nuestras defensas nos ataquen?
Un comienzo a contracorriente (1970–1974)
A inicios de la década de 1970, laboratorios liderados por Richard Gershon y Kazuhiko Kondo documentaron algo que chocaba con el relato heroico de la inmunología: los linfocitos T no son solo parte de nuestro sistema de defensa, también pueden imponer tolerancia. Desde hacía tiempo se sabía que en el timo, una glándula localizada atrás del esternón, era donde maduraban los linfocitos T. Si en ratones recién nacidos se eliminaba el timo, la tolerancia desaparecía, presentándose enfermedades autoinmunes. Para sorpresa general, encontraron que, si inyectaban en estos ratones un extracto de timo procedente de ratones normales, se reestablecía la tolerancia. Sí, la tolerancia podía “contagiarse” a otros animales, fenómeno bautizado como tolerancia infecciosa, posteriormente llamada tolerancia central. Poco después, grupos japoneses demostraron que los linfocitos T podían apagar respuestas de anticuerpos contra diferentes retos, tocando por primera vez la posibilidad de que existiera un subconjunto supresor que llamaron linfocitos T supresores. No se conocían los detalles, pero sí un hecho, algunas células T reducían activamente la respuesta contra lo propio (Figura 1).
El entusiasmo, sin embargo, no se tradujo en un consenso estable. La biología de aquellas células era elusiva, dependiente de sistemas frágiles, y la técnica de la época no ayudaba. Lo que para unos eran señales inequívocas, para otros eran artefactos de cultivo.
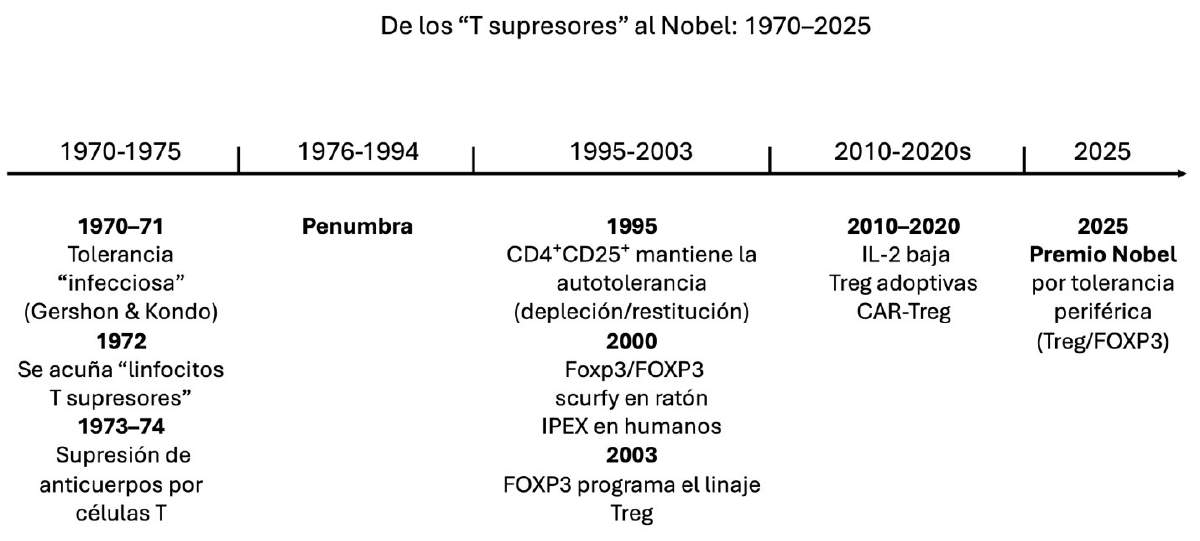
Figura 1. De las primeras pistas de supresión por linfocitos T al linaje FOXP3⁺ y su salto a la clínica: medio siglo de investigación que culmina en el Premio Nobel 2025. Fuente: elaboración propia.
El páramo: por qué el campo se estancó (1974–1995)
Durante dos décadas, la “supresión” quedó en una especie de limbo científico. Varias causas se encadenaron: por un lado, se sabía el fenómeno, pero no era claro qué tipo de célula había que buscar. Hay muchos tipos de linfocitos que componen el sistema inmune, diferenciables por el tipo de proteínas que producen en su superficie. Identificar cuál de todos ellos era el responsable era una tarea difícil, complicada además por la poca eficiencia en esa época de las tecnologías para aislar poblaciones de células de un tipo específico. El fenómeno de tolerancia era además difícil de reproducir, debido a variaciones tanto en condiciones de laboratorio como en la pureza de los reactivos empleados. Más aún, la genética con células de mamíferos estaba aún en sus albores, así como la posibilidad de obtener secuencias de genomas y localizar genes específicos. En ciencia, a veces los fenómenos interesantes se encuentran antes de que existan las estrategias para resolverlos y este es un buen ejemplo de ello. Tuvieron que resolverse todas estas dificultades antes de poder abordar bien el problema. Fue un periodo estéril en términos de contestar la pregunta central acerca de la tolerancia, pero fructífero en desarrollar las estrategias para lograrlo.
El giro que lo cambió todo (1995): la prueba causal
El renacimiento llegó con una fórmula tan simple como impecable. En 1995, el grupo de Shimon Sakaguchi encontró que si a ratones carentes de timo (recordemos, estos carecían de tolerancia inmunológica, por lo que desarrollaban enfermedades autoinmunes) se les restituían linfocitos T procedentes de la sangre (no del timo), los ratones se mantenían sanos, indicando que se restablecía la tolerancia (Figura 2). La conclusión es que no solo había tolerancia inmunológica central (causada por linfocitos T en el timo) sino también tolerancia inmunológica periférica (causada por linfocitos T en la sangre periférica).
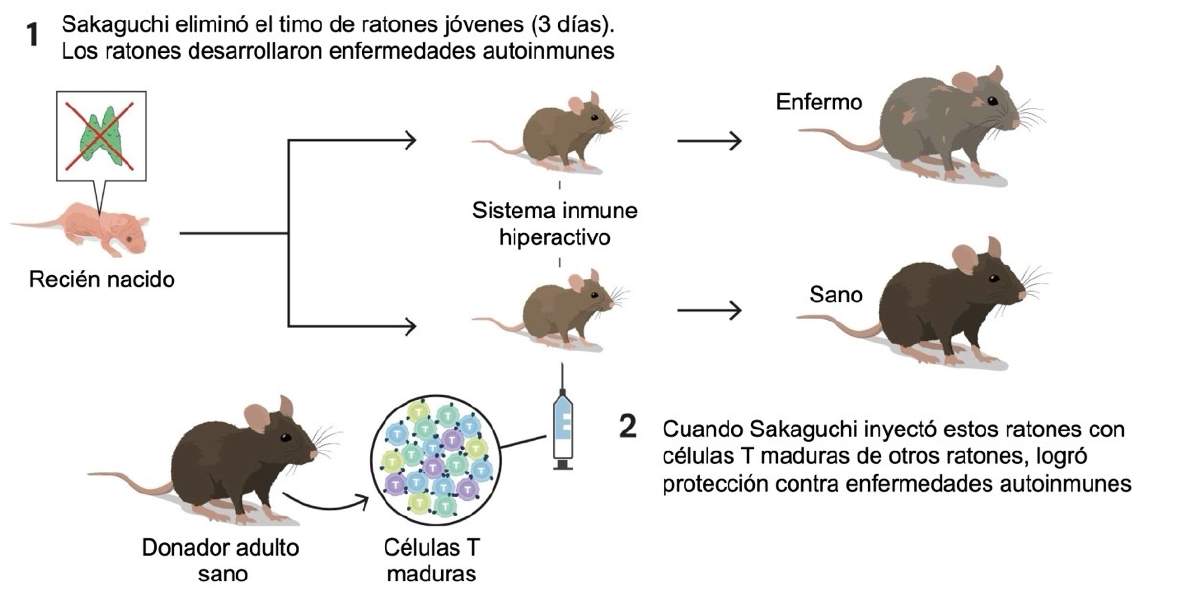
Figura 2. Demostración de la tolerancia inmunológica periférica. Fuente: traducción al español de una figura original de la Fundación Nobel (© The Nobel Committee for Physiology or Medicine. Ill. Mattias Karlén, https://www.nobelprize.org/prizes/medicine/2025/press-release/)
Aprovechando las ventajas de poder trabajar con linfocitos T procedentes de sangre (en lugar de emplear el timo), en conjunto con los avances experimentales, el grupo de Sakaguchi logró identificar un subconjunto de linfocitos T que expresaban la proteína CD4⁺ en su superficie, pero que también producían la proteína CD25. Al eliminar estos linfocitos T CD4⁺CD25⁺, los animales desarrollaban autoinmunidad; al reponerlos, la tolerancia volvía. Aquella demostración de depleción-restitución fue el punto de inflexión, por fin existía una población aislable, medible y analizable con un efecto causal sobre la tolerancia. A partir de ahí, los hallazgos se desencadenaron: esas células presentaban todas las características esperadas de un linfocito T supresor, incluyendo la capacidad de suprimir la activación de otras células T. Por esta razón, estas células ahora se denominan linfocitos T reguladores o Tregs.
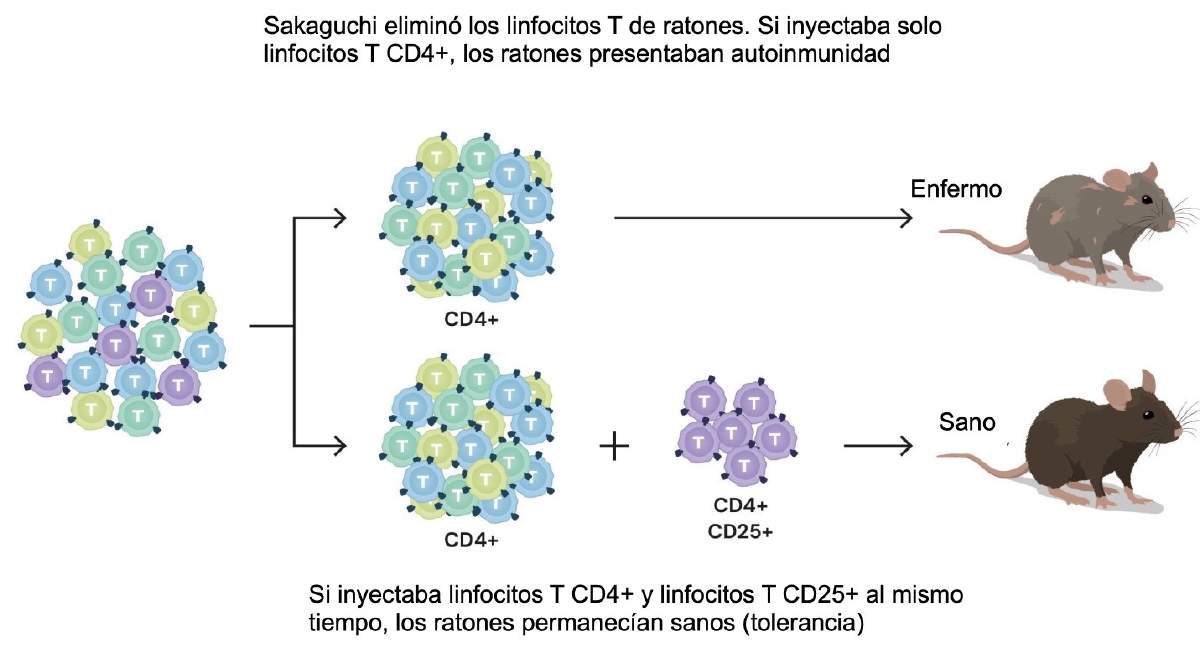
Figura 3. Una subpoblación de linfocitos T (Tregs) son responsables de la tolerancia inmunológica periférica. Fuente: traducción al español de una figura original de la Fundación Nobel (© The Nobel Committee for Physiology or Medicine. Ill. Mattias Karlén, https://www.nobelprize.org/prizes/medicine/2025/press-release/)
El ancla genética (2001–2003): FOXP3 programa el linaje
El círculo se cerró cuando la genética entró en escena. En 2001, Mary E. Brunkow y Fred Ramsdell demostraron que la dramática autoinmunidad presentada por el ratón mutante scurfy se debía a mutaciones que afectaban el gene Foxp3 (Figura 4), y casi a la par, investigadores clínicos encontraron que mutaciones en FOXP3 eran responsables de una enfermedad autoinmune, el síndrome IPEX en humanos (llamado así porque se presenta inmunodisregulación, poliendocrinopatía y enteropatía ligada al cromosoma X).
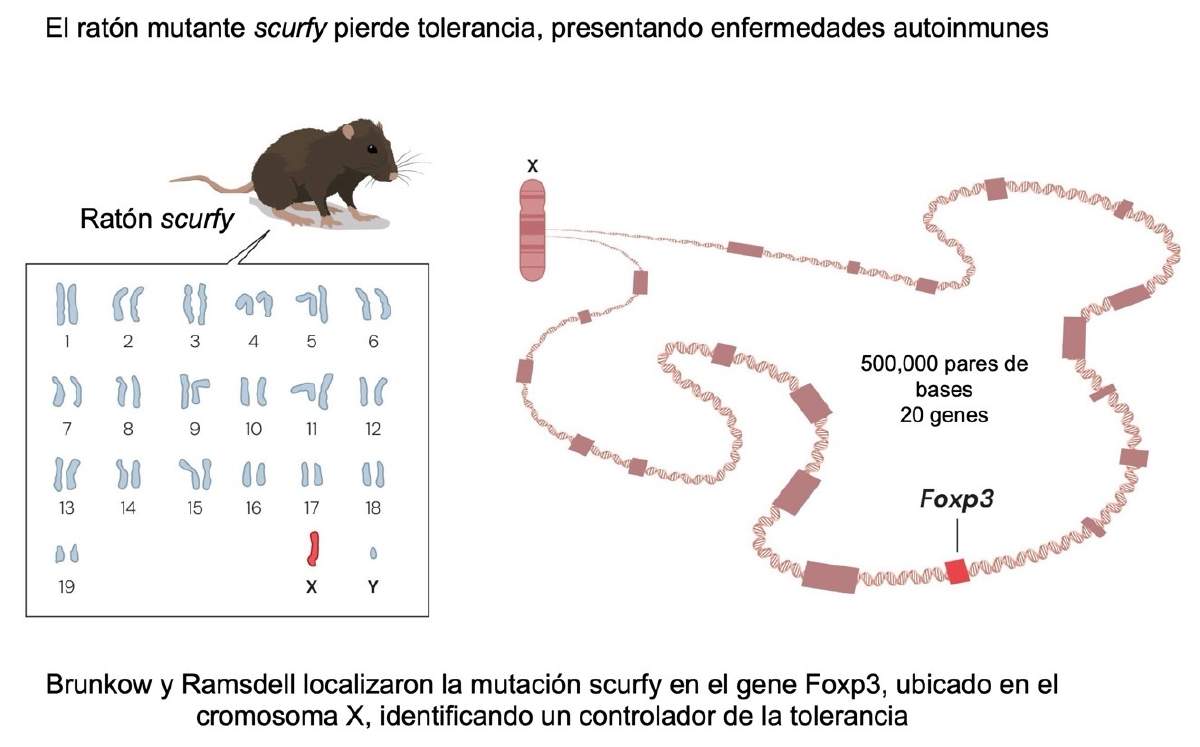
Figura 4. Identificación de Foxp3, un gene responsable de la tolerancia inmunológica periférica. Fuente: traducción al español de una figura original de la Fundación Nobel (© The Nobel Committee for Physiology or Medicine. Ill. Mattias Karlén, https://www.nobelprize.org/prizes/medicine/2025/press-release/)
Dos años después, nuevos trabajos mostraron que Foxp3 es necesario y suficiente para lograr tolerancia. Si se fuerza la expresión de este gene en linfocitos T que no participan en tolerancia, ahora estos presentan rasgos de células T reguladoras (Treg); la pérdida de la expresión del gene borra estos rasgos.
Con linfocitos T CD25+ para aislar y la expresión de FOXP3 para definir el destino de estas células, el campo pasó de un comportamiento huidizo a un linaje FOXP3⁺ con papel crucial en la tolerancia. Lo que antes eran “supresores” se consolidó como Treg con pasaporte genético.
¿Por qué el Nobel 2025?
El reconocimiento no premia un hallazgo puntual, sino una trayectoria intelectual: (1) la identificación funcional de un subconjunto de células que impone tolerancia; (2) la base genética que explica su existencia y su pérdida en enfermedad; y (3) la traslación clínica que ya empieza a cambiar la vida de pacientes con afecciones autoinmunes. La selección de los galardonados simboliza ese arco completo: de la fisiología básica a la terapéutica.
¿Qué hacen realmente las Treg?
La metáfora es conocida pero útil: las Treg son los frenos del sistema inmune. Están caracterizadas por la expresión de FOXP3, alto CD25, CTLA-4 y otras moléculas. Esto les permite ejercer una variedad de funciones necesarias para la tolerancia inmunológica. Ante la presencia de linfocitos T que pudieran dañar componentes propios, las Treg pueden (a) desarmar a los linfocitos atacantes, a través de modular a las células dendríticas, necesarias para activación, (b) ayunar a los linfocitos agresores, compitiendo por la disponibilidad de IL-2 (combustible que le quitan a linfocitos T efectores), (c) bloquear la identificación de las células que pudieran ser víctimas del ataque, a través de capturar componentes como CD80/86 y, (d) reducir la inflamación, liberando citocinas inhibitorias (Figura 5). Su misión es una gobernanza fina: defender sin autolesionarse y apagar la hoguera para que no haya incendio. De ahí su paradoja terapéutica: faltan, aparece autoinmunidad; sobran (o se acumulan en el tumor), la defensa antitumoral se ahoga.
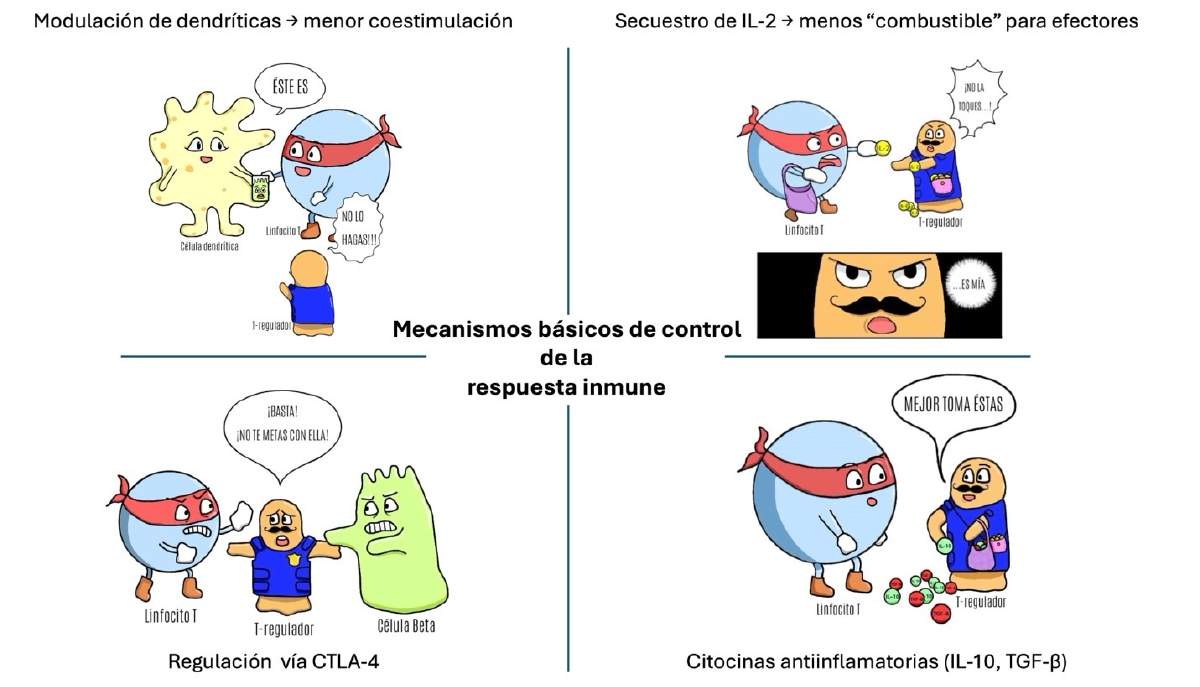
Figura 5. Estrategias de las Tregs para establecer la tolerancia inmunológica. Fuente: Fernanda García Espinoza
Del laboratorio a la clínica: aplicaciones que ya están en marcha
Además de ayudarnos a comprender un fenómeno biológico básico, las Tregs ofrecen alternativas que cambiarán la práctica médica (Figura 6).
1) Autoinmunidad e inflamación
La estrategia clínica más madura se basa en un principio elegante: nutrir los frenos sin pisar el acelerador. La idea es que dosis bajas de IL-2 expanden selectivamente las Treg —por su alto CD25— sin activar en exceso a otros linfocitos. Actualmente ya hay ensayos iniciales con algunas enfermedades autoinmunes como el lupus o la diabetes tipo 1, donde la expansión de Tregs lleva a una mejoría clínica. Serán necesarios estudios más amplios y la combinación con otros medicamentos para prolongar el efecto de tolerancia y su precisión. No es inmunosupresión ciega: es un ajuste fino del termostato.

Figura 6. Alternativas de las Tregs en la práctica médica. Fuente: elaboración propia.
2) Tolerancia en trasplantes
En una época en la que el trasplante de varios órganos es posible, persiste un problema. Nuestro organismo, al reconocer al órgano trasplantado como ajeno, lo atacará con su sistema inmune. Para evitar esto, se emplean medicamentos que acallan al sistema inmune en general, haciendo al paciente, de por vida, inerme ante el ataque de diferentes enfermedades. La visión es reemplazar esta inmunosupresión generalizada por tolerancia de precisión. La idea es hacer una terapia adoptiva con Tregs donde se recolectarían, se expandirían y se modificarían Tregs del propio paciente para reinfundirlos y lograr que el órgano trasplantado sea invisible al sistema inmune del paciente. Los estudios buscan seguridad, direccionamiento al injerto y reducción de fármacos. Si funcionan, serán un cambio de paradigma: inmunomodulación localizada en lugar de apagar todo el sistema.
3) Enfermedad injerto contra huésped (EICH)
Tras un trasplante de médula ósea, los linfocitos del donante pueden atacar tejidos del receptor. La infusión de Tregs del donante se perfila como un medicamento vivo para amortiguar esa reacción. Ensayos clínicos en fases todavía iniciales muestran seguridad y señales de eficacia; ensayos controlados más amplios dirán hasta dónde llega la promesa.
4) Alergia y asma
La alergia es, en el fondo, un fracaso de la tolerancia frente a estímulos inocuos. Programas que potencian Tregs —desde inmunoterapia con alérgenos hasta combinaciones con IL-2 baja— buscan reeducar al sistema para que ignore polen, alimentos o ácaros sin desarmar la defensa frente a patógenos.
5) Cáncer: cuando hay que soltar los frenos
Los tumores explotan la biología de las Tregs: las reclutan para crear microambientes inmunes letárgicos. La estrategia que siguen estos tumores es diabólica: hacerse invisibles al sistema inmune. Por eso, algunas inmunoterapias (p. ej., anti-CTLA-4) funcionan mejor cuando, además de bloquear señales, depletan Tregs intratumorales. La frontera es de precisión: quitar frenos al sistema inmune dentro del tumor y de sus ganglios de drenaje, sin desatar autoinmunidad sistémica. Es la cara complementaria de la historia: donde sobra tolerancia, hay que aflojarla con precisión.
De nota al margen a titular
Lo que empezó como una herejía —que unos linfocitos pusieran el pie en el freno— terminó reconfigurando el sistema operativo de la inmunología. Hoy podemos programar tolerancia con un gen (FOXP3), dosificarla con una citocina (IL-2), transferirla como medicamento vivo (Treg adoptivas) o relajarla estratégicamente para liberar la inmunidad antitumoral. La llamada “brecha” 1974–1995 ya no es un vacío vergonzante, sino una lección: sin identidad celular, herramientas y genética, incluso las buenas ideas se congelan; con ellas, florecen.
El Premio Nobel 2025 en Fisiología o Medicina no solo celebra a tres nombres propios; consagra un cambio de mentalidad. La medicina del siglo XXI no será la de apagar incendios con mangueras cada vez más potentes, sino la de gestionar el fuego: decidir qué se apaga, qué se mantiene y qué se aviva. En esa tarea, las Treg han pasado de sospechosas a arquitectas de un nuevo equilibrio terapéutico. Y ese, más que cualquier experimento aislado, es el verdadero premio de medio siglo de trabajo.
Para saber más
Nobel Prize in Physiology or Medicine 2025. https://www.nobelprize.org/prizes/medicine/2025/press-release/
Wikipedia. Tolerancia inmunitaria. https://es.wikipedia.org/wiki/Tolerancia_inmunitaria
Wikipedia. Tolerancia periférica. https://es.wikipedia.org/wiki/Tolerancia_perif%C3%A9rica
Esta columna se prepara y edita semana con semana, en conjunto con investigadores morelenses convencidos del valor del conocimiento científico para el desarrollo social y económico de Morelos.


