El Dr. Miguel Ángel Cevallos (mejor conocido como MAC) estudió Biología Experimental en la UAM-I y posteriormente el Doctorado en Investigación Biomédica Básica en la UNAM. Actualmente es investigador Titular en el Centro de Ciencias Genómicas de la UNAM.
Esta publicación fue revisada por el comité editorial de la Academia de Ciencias de Morelos.
Dedicado a Carmen, donde quiera que esté.
Extraño a Carmen, amiga entrañable que falleció hace décadas, poco después de salir de la universidad (Figura 1). Apenas si llegó a sus treintas. Murió como consecuencia de un cáncer cervicouterino, que se la llevó en poco tiempo y de mala manera. Desafortunadamente, el caso de Carmen no es único, ni raro: literalmente miles de mujeres sucumben al año a causa de este flagelo. La Organización Mundial de la Salud (OMS) nos dice que sólo en el año 2022, el cáncer cervicouterino le arrebató la vida a 350,000 mujeres alrededor del mundo, incluyendo a 4,909 mexicanas. Y lo peor de todo, las mujeres jóvenes como Carmen son, por mucho, las víctimas más frecuentes. Estos fallecimientos no ocurren al azar: mientras más pobre es el país y los servicios de salud más deficientes, el número de mujeres que mueren a causa esta enfermedad es mayor. En este momento el África subsahariana es la región del planeta que contribuye con más de estos lamentables casos. Lo más triste de todo esto, es que la mayor parte de estos decesos pudieron haberse evitado con la aplicación de una simple vacuna.

Figura 1. Mi amiga Carmen.
La causa más común del cáncer cervicouterino es el Virus del Papiloma Humano de alto riesgo
Si, así es, la infección con los Virus del Papiloma Humano (VPH), específicamente los llamados de alto riesgo son una causa común del cáncer cervicouterino y de otros tipos de cáncer como lo son el cáncer orofaríngeo, el de ano, el de cuello y cabeza, y el de vulva y vagina. Si eres hombre y estás leyendo estas líneas, no te sientas fuera de peligro, los papilomavirus humanos de alto riesgo son también los responsables del cáncer de pene (si, leíste bien), cáncer poco frecuente pero que sin duda existe, y los responsables de una proporción de casos de cáncer de boca y faringe, que es más común en los hombres que en las mujeres.
Pero expliquemos las cosas con calma, para que todo se contemple en sus reales proporciones: existe una enorme variedad de papilomavirus humanos, todos ellos pueden infectar la piel y las mucosas. La mayor parte de estos virus causan infecciones básicamente imperceptibles, que no menoscaban la salud y que se suelen resolver solas e incluso hay variantes como el VPH-5 que persisten toda la vida sin que el individuo afectado se dé cuenta. Sin embargo, no todo es miel sobre hojuelas: hay variantes que no producen cáncer, pero si verrugas en distintas partes del cuerpo como en las manos, los pies (especialmente la planta de los pies, Figura 2A), los codos, las rodillas e incluso alrededor de las uñas (Figura 2B). Estas lesiones, aunque feas se resuelven solas en algunas semanas o meses. El mecanismo más común de trasmisión de estos virus son los contactos piel con piel.
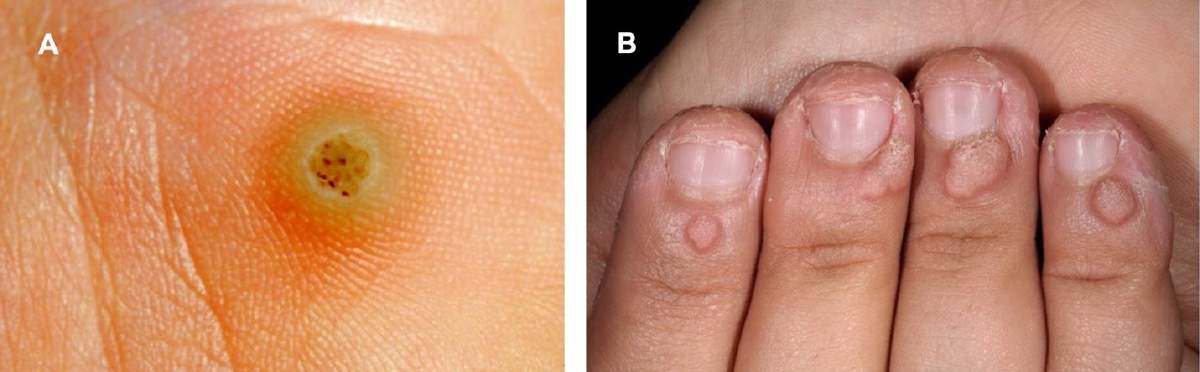
Figura 2. Verrugas causadas por papilomavirus. A, verruga en la planta del pie (https:// podoxativa.com/verrugas/); B, verrugas alrededor de las uñas (https://dbdermatologiabarcelona.com/verrugas/).
Hay otras variantes de los papilomavirus que se trasmiten sexualmente. Algunos de ellos producen verrugas en el ano y en los genitales. Sin embargo, las variantes llamadas de alto riesgo son las que están claramente ligadas a los cánceres (variantes oncogénicas, si les gustan los términos técnicos) que mencioné más arriba. Entre ellas, las más comunes y agresivas son las variantes VPH-16 y VPH-18. De hecho, este par de virus son los responsables de algo así como del 70% de todos los canceres cervicouterinos. Tengo que mencionar que estas dos variantes definitivamente no son las únicas peligrosas, hay alrededor de una docena de ellas circulando en la población.
Descubrimiento
Los papilomavirus no son exclusivos de los humanos, hay también papilomavirus que infectan a los animales. Para ser más claro: hay papilomavirus especializados en infectar, por ejemplo, vacas, otros infectan a los hámsteres, unos más a los conejos, etc. Básicamente todos los mamíferos tienen asociados sus papilomavirus. No sólo eso, se han podido aislar este tipo de virus en peces, aves y en diversos reptiles. En todos esos animales los papilomavirus pueden causar verrugas y cánceres de diversos tipos.
La primera pista de que las verrugas se producían a través de un agente infeccioso la obtuvo un famoso cazador de virus: Richard E. Shope (Figura 3). Él fue capaz de inducir la aparición de verrugas al infectar conejos sanos con extractos obtenidos de verrugas de conejos enfermos, allá por los años 30 del siglo pasado. La primera observación directa de que este agente infeccioso era un virus, la obtuvieron en 1949 un grupo de investigadores de la Escuela de Medicina de la Universidad de Yale (EUA), a través de técnicas de microscopía electrónica. Sin embargo, no fue sino hasta 1975 cuando se aisló y purificó el primer papilomavirus humano, por cierto, de verrugas de las plantas de los pies. En las siguientes décadas hubo una explosión en el aislamiento y descripción de decenas de papilomavirus, tanto humanos como de origen animal: hasta el momento se han descrito más de 230 variantes de papilomavirus humanos.

Figura 3. Richard E. Shope (1901-1966). https://en.wikipedia.org/wiki/Shope_papilloma_virus#/media/File:Richard_Edwin_Shope.jpg
La idea de que el cáncer cervicouterino es una enfermedad infecciosa que se transmite sexualmente, aunque ustedes no lo crean, es súper vieja: resulta que el médico italiano Domenico Antonio Rigoni-Stern, en 1842, estudiando un grupo de prostitutas y otro de monjas, se dio cuenta que el cáncer cervicouterino era mucho más prevalente en el primer grupo que el de las monjas (que seguramente eran muy bien portadas), prueba contundente de que el cáncer cervicouterino es mayoritariamente una enfermedad contagiosa de transmisión sexual.
El siguiente gran paso lo realizó el virólogo alemán Harald zur Hausen quién demostró que los tumores de cérvix contenían DNA de papilomavirus incorporado al material genético de las células tumorales, y que ese papilomavirus al que llamó VPH-16 era distinto a los papilomavirus que producen verrugas. Este descubrimiento le hizo merecedor del premio Nobel de medicina en el 2008 y dió pie a un montón de estudios que se centraron tanto en los mecanismos de infección, como en la descripción molecular de cómo los VPH de alto riesgo son capaces de inducir el cáncer.
Anatomía del enemigo
Los papilomavirus son virus relativamente pequeños, cuyo material genético es una mólecula de DNA de doble cadena que porta las instrucciones para la síntesis de siete a nueve proteínas, dependiendo de la variante. El material genético de estos virus se resguarda en una “cajita” llamada cápside, que está conformada por dos proteínas llamadas L1 y L2, que por cierto, sobre todo la primera, es muy variable y ha sido la base para el diseño de las vacunas existentes contra este VPH. Las proteínas de la cápside son especialmente importantes, porque son éstas las que detecta primero nuestro sistema inmune y por tanto son esenciales para poder reconocer al virus y montar una buena línea de defensa. Las otras proteínas sintetizadas por el papilomavirus (E1 a la E7) son esenciales para que el virus cumpla con su ciclo de replicación y de maduración. Hay dos de ellas, la E6 y la E7 que, como veremos más adelante, juegan un papel muy importante en la inducción del cáncer y por ello también se les llama oncoproteínas o proteínas inductoras de tumores.
Infección y cáncer
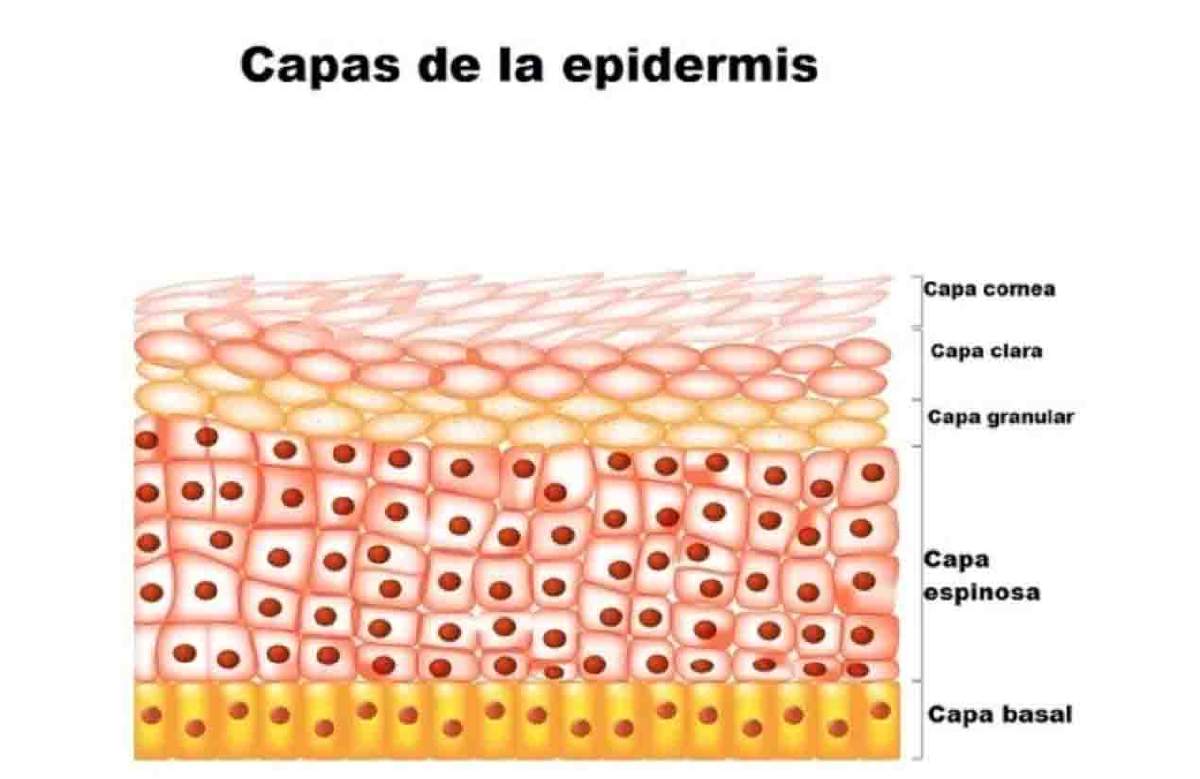
Los papilomavirus tienen dietas muy restringidas, ya que sólo pueden infectar a un tipo de células: los queratinocitos del estrato basal, localizados en la capa más profunda de nuestra piel y en los llamados epitelios mucosos, que son los tejidos que revisten el interior de las superficies húmedas de nuestro cuerpo, por ejemplo, el de la cavidad oral (Figura 4). El virus aprovecha cualquier pequeña herida en nuestra piel o incluso micro abrasiones, para iniciar la infección. Una vez que el virus penetra a los queratinocitos del estrato basal, su material genético llega al núcleo de esa célula a través de un complejo mecanismo, y es ahí donde el virus se empieza a multiplicar, pero sin integrarse a nuestros cromosomas. En caso de infección con VPH de bajo riesgo se forman las verrugas que ya mencioné. Sin embargo, el problema más grave ocurre cuando se da una infección por variantes de VPH de alto riesgo, ya que la información genética de éstas suele insertarse en alguno de nuestros cromosomas. La inserción en sí misma puede iniciar el cáncer, pero la manera más común es que los genes virales E6 y E7, una vez integrados en nuestro genoma, se prendan y obliguen a los queratinocitos del estrato basal a convertirse, en vez de en una verruga, en una célula tumoral con crecimiento descontrolado, y esto ocurre porque E6, secuestra a la proteína humana p53 y E7 a la proteína Rb, ambas esenciales para que las células de nuestro cuerpo crezcan de la manera ordenada y bajo control. De hecho, p53 y Rb se les conoce como proteínas supresoras de tumores, así es que, si se le secuestra y para decirlo pronto y mal, todo se va a la m…basurero (o cualquier otro sustantivo que quieran utilizar aquí).
Las vacunas
Es increíble el tiempo que puede pasar para que una vacuna u otro biofármaco salga a la venta. Pueden pasar décadas y no todo ese tiempo es dedicado a investigación en el laboratorio o a pruebas clínicas. Muchas veces este proceso se alarga por luchas por la propiedad intelectual, las patentes y los pasos necesarios tener a punto un producto que se pueda producir a gran escala y vender como producto comercial. Este es el caso de las vacunas contra el VPH. Desde el descubrimiento básico de que el VPH es causante del cáncer cervicouterino (1983) hasta el primer ensayo clínico de la vacuna contra este virus (2002) pasaron 19 años, en medio una dura batalla legal entre investigadores australianos de la Universidad de Queensland, liderados por el Dr. Ian H. Frazer y los Dres. Douglas R. Lowy y John T. Schiller investigadores americanos. El problema se resolvió en favor de los australianos hasta 2006, ante una corte de patentes. Pero a pesar de esto, la historia no es tan simple.
Una técnica común para producir vacunas, sobre todo en los albores de las vacunas, era multiplicar al virus de interés, purificarlo y luego inactivarlo por algún medio físico o químico. Posteriormente, este producto se dosificaba para que su aplicación en las personas indujera la respuesta inmune deseada. Ahora las nuevas técnicas de biología molecular han dejado atrás, en muchos casos, este rudimentario método. No importa por qué medio se fabriquen las vacunas, todas tienen que pasar por estrictos ensayos clínicos antes de que puedan usarse en la gente. El problema con los papilomavirus es que no se pueden crecer en condiciones de laboratorio y por ello los primeros investigadores interesados en el desarrollo de las vacunas contra los papilomavirus usaron todo un novedoso y variado herramental de trucos genéticos y de biología molecular.
A los inicios de la década de los 90’ los Dres. Ian Frazer y Jian Zhou estaban interesados en estudiar como ocurría la respuesta inmune frente a la infección del papilomavirus HPV-16. Para resolver el problema de no poder cultivar el virus en el laboratorio, se les ocurrió fabricar vesículas con las proteínas L1 y L2 producidas con técnicas de ingeniería genética. Estas vesículas, a las que llamaron virus-like particles o VLPs (partículas similares a virus, Figura 5), eran casi idénticas en su superficie a como se encuentran en la cápside de los papilomavirus y con ellas pudieron iniciar sus investigaciones.
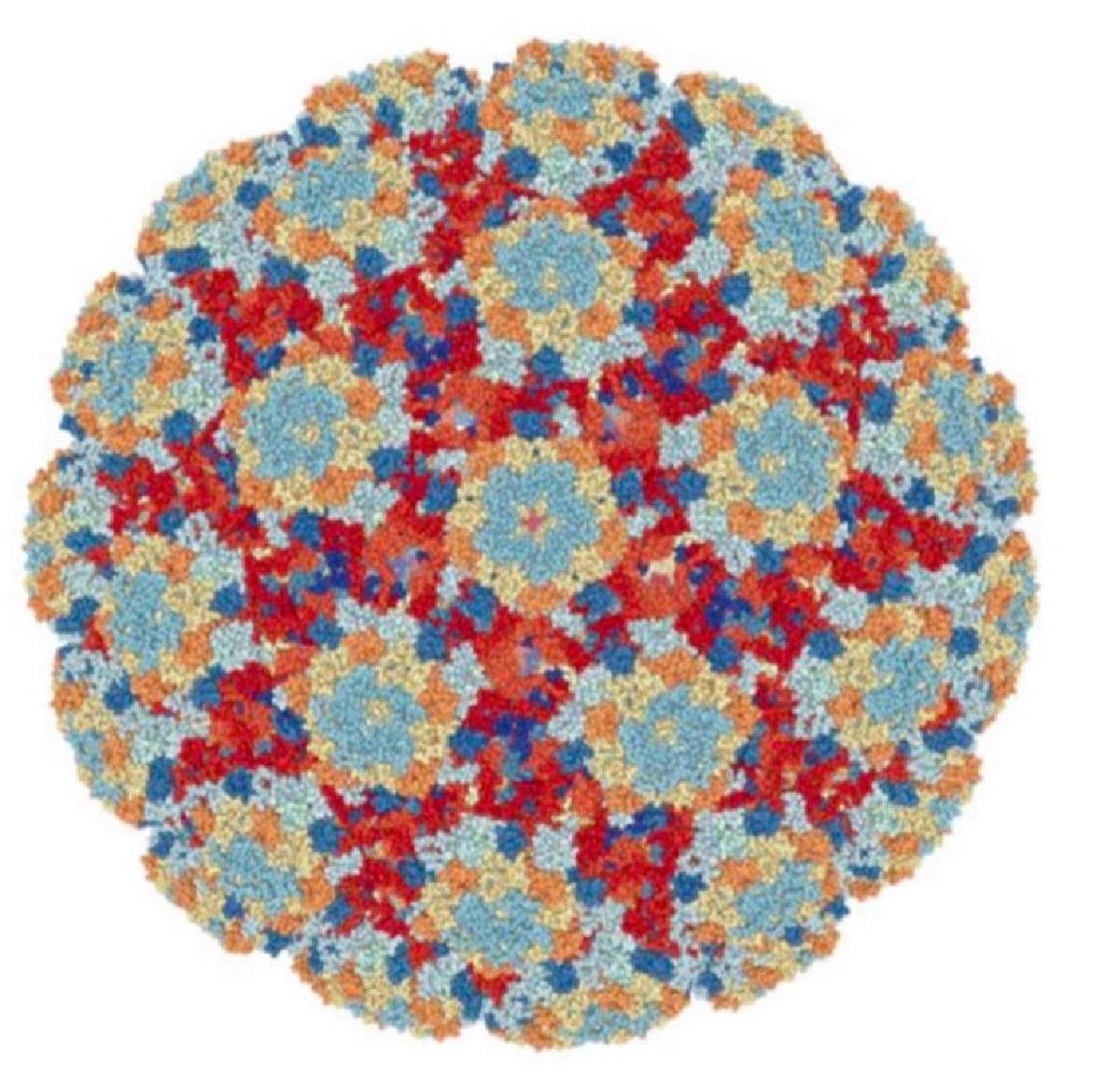
Figura 5. Partículas similares a virus (VLP) conteniendo 72 pentámeros de la proteína L1 del papilomavirus humano. Figura tomada de Frazer (ver lecturas adicionales).
Casi al mismo tiempo, Lowy y Schiller tuvieron una idea similar, pero con el fin expreso de producir una vacuna contra el papilomavirus humano. Para ello, primero decidieron trabajar con papilomavirus animales, y poder hacer así ensayos en el laboratorio. Estos investigadores pudieron elaborar VPLs, con la proteína L1 y que al ser está la proteína más abundante de la cápside, ellos suponían que bastaba para inducir una respuesta inmune. Luego de arduas investigaciones pudieron demostrar que, si inoculaban conejos con VPLs elaborados con proteínas L1 de conejo, los hacían completamente inmunes a infecciones con el virus silvestre. Con estos prometedores datos en mano, contactaron tanto a la compañía Merck como a MedImmune (hoy GlaxoSmithKline), ambas con mucha experiencia en la investigación y producción a gran escala de vacunas, para que desarrollaran vacunas contra los papilomavirus humanos, utilizando la técnica que habían puesto a punto. El primer ensayo clínico, realizado en el 2001, empleó como vacuna las VPLs hechas con la proteína L1 del VPH-16, en un pequeño grupo de voluntarios. La prueba fue todo un éxito.
Ensayos clínicos prosteriores y en mucho mayor escala, demostraron la seguridad y gran eficacia de esta vacuna. En el 2006, la FDA, organismo estadounidense que evalúa, vigila y aprueba los fármacos y las vacunas en los Estados Unidos (el equivalente nacional de la COFEPRIS), otorgó permiso a Merck para fabricar y comercializar su vacuna contra el VPH-16 (Gardasil) y 3 años después hizo lo mismo para la vacuna de GlaxoSmithKline contra VPH16 y VPH-18. Casi veinte años después, contamos con una amplia gama de vacunas contra el VPH, ya que hay en el mercado algunas que nos protegen contra las variantes VPH16 y VPH-18; otras, las tetravalentes, nos defienden contra los virus VPH-6, VPH-11, VPH16 y la VPH-18, y por último, se ofrece una nonavalente (Gardasil 9) que confiere inmunidad contra nueve variantes: VPH-6, VPH-11, VPH16 , VPH-18, VPH-31, VPH-33, VPH- 45, VPH-52 y VPH-58. En la actualidad, en nuestro continente, todos los países y territorios han introducido la vacuna contra el papilomavirus en sus esquemas de vacunación y la mayor parte de ellos utiliza una vacuna tetravalente.
Con una meta clara
Con estas herramientas en mano y con la posibilidad real para desterrar para siempre las infecciones por VPH como causa del cáncer cervicouterino, la OMS se ha propuesto cumplir para el 2030 el llamado plan 90-70-90, que consiste en vacunar al 90% de todas las niñas menores de 15 años; examinar con técnicas de alta precisión para detectar posibles lesiones precancerosas al 70% de las mujeres antes de los 35 años y una vez más antes de los 45 años, y por último, se dará tratamiento médico al 90% de las mujeres diagnosticadas con lesiones precancerosas o ya con cáncer cervicouterino. Con este plan la OMS piensa que, para el 2030, se podrá evitar la muerte de al menos 300,000 mujeres y en el 2070, de 14 millones.
¿Y en México?
En México, el cáncer cervicouterino es el segundo cáncer más frecuente en las mujeres y el segundo también en llevarlas a la muerte; la mayor parte de las víctimas son las Chiapanecas y las de Quintana Roo, indudablemente por las condiciones socioeconómicas en que se encuentran. Tener en casa una paciente de cáncer, enferma emocionalmente a toda la familia y su tratamiento genera un estrés económico tremendo y muchas veces irresoluble. En promedio, el 10.3% de las mujeres están infectadas por papilomavirus. Nuestro país para que pueda alinearse con el plan 90-70-90 de la OMS, tiene muchísimo camino por recorrer, ya que las muertes por cáncer cervicouterino no han disminuido al ritmo esperado. Solo un pequeñísimo porcentaje de las mujeres se hace exámenes citológicos rutinarios (Papanicolaou) y menos aún pruebas de detección de VPH. Se está haciendo un esfuerzo para que este último examen se popularice, ya que es capaz de detectar 9 de cada 10 casos de mujeres con lesiones precancerosas. El problema es que no hay información digerible, ni programas que fomenten estos análisis rutinarios.
La campaña de vacunación contra el VPH se inició en México en el 2012 y su meta era vacunar a todas las niñas de quinto grado de primaria o que tuvieran 11 años, si no iban a la escuela. Esa primera campaña exigía tres dosis: dos dosis, primero, con 6 meses de separación y una última dosis, cinco años después. En 2014 se simplificó el esquema a dos dosis, con seis meses de separación. Esto evidentemente permitió ampliar la cobertura y disminuir los costos, sin perder mucha eficacia. Sin embargo, la OMS analizando los resultados de los esquemas de vacunación, en el 2022, determinó que bastaba sólo una aplicación para conferir una buena protección. Nuestro país, desde ese año, está siguiendo las recomendaciones emitidas por este organismo. El esquema actual de vacunación (2025) incluye a las niñas, a los niños y a los adolescentes (los varones, estuvieron excluidos por años). Tengo que mencionar que este esquema también incluye tres dosis de vacuna para las mujeres cis y trans que viven con VIH. También me congratulo que la vacuna que se usa actualmente en México es excelente, la nonavalente (Gardasil 9).
Epílogo
No bastan los programas de vacunación gubernamentales, tenemos que poner de nuestra parte. Debemos llevar a nuestras niñas, niños y adolescentes a que se vacunen. También debemos asegurarnos de que nuestras compañeras de vida o nuestras hijas acudan a revisión ginecológica de manera periódica, si son menores de 30 años a análisis citológico y si son mayores de 30 años a análisis citológico acompañado de detección molecular del VPH. Por último, indudablemente el sexo seguro es una extraordinaria medida para evitar infectarnos. Si todos participamos eliminaremos el cáncer cervicouterino de nuestras vidas.
Lecturas adicionales
- Centro Nacional para la Salud de la Infancia y Adolescencia (17 de noviembre de 2022). Actualización de esquema de vacunación contra Virus del Papiloma Humano (VPH). https://www.gob.mx/salud/censia/documentos/actualizacion-de-esquema-de-vacunacion-contra-virus-del-papiloma-humano-vph
- INEGI (30 de enero de 2025). Estadísticas a propósito del Día Mundial contra el Cáncer.https://www.inegi.org.mx/contenidos/saladeprensa/aproposito/2025/EAP_DMvsCancer25.pdf
- Geddes, L. (8 de octubre de 2024). How HPV vaccines and new screening methods could help eliminate cervical cancer. https://www.gavi.org/vaccineswork/how-hpv-vaccines-and-new-screening-methods-could-help-eliminate-cervical-cancer?gad_source=1&gad_campaignid=12319817265&gbraid=0AAAAADibICOaVEJZ-T7g6_6DZsAdqj9BM&gclid=Cj0KCQjw8KrFBhDUARIsAMvIApaNf1c5vY6CiL4QyUe96mLE0QV-2_j6qys4JerwL9YH7ldWHNFWZcEaAoqsEALw_wcB
- Frazer, I. H. (2019). The HPV Vaccine Story. ACS Pharmacol Transl Sci. 2(3):210-212. doi: 10.1021/acsptsci.9b00032.
Esta columna se prepara y edita semana con semana, en conjunto con investigadores morelenses convencidos del valor del conocimiento científico para el desarrollo social y económico de Morelos.