El Dr. Dubrovsky es investigador del Instituto de Biotecnología de la Universidad Nacional Autónoma de México, en Cuernavaca, Morelos. Su área de especialidad es el desarrollo de plantas a nivel celular y molecular y mecanismos involucrados en el desarrollo de la raíz. Es miembro de la Academia de Ciencias de Morelos.
Esta publicación fue revisada por el comité editorial de la Academia de Ciencias de Morelos.
Sales de platino contra cáncer y las plantas
En un artículo publicado recientemente en estas páginas (1) se relatan los experimentos del químico americano de la Universidad Estatal de Michigan, Dr. Barnett Rosenberg. Rosenberg descubrió que un compuesto de platino, generado fortuitamente durante sus experimentos, tenía un potente efecto sobre el crecimiento de las bacterias, bloqueando su división. Para su sorpresa, este mismo compuesto mostró un efecto inhibitorio sobre la proliferación celular en mamíferos. El compuesto activo es una sal de Platino, llamada sal de Peyrone o cis-diaminodicloroplatino(II) (cis-[PtCl2(NH3)2]), también conocida como cisplatino (2), cuya estructura se muestra en la Figura 1. Actualmente, el cisplatino y sus derivados se usan activamente en tratamiento de cáncer, teniendo un efecto inclusive curativo en algunos tipos de cánceres (https://es.wikipedia.org/wiki/Cisplatino). Este es un ejemplo de la necesidad de explorar la acción de diferentes compuestos químicos para combatir esta grave enfermedad.
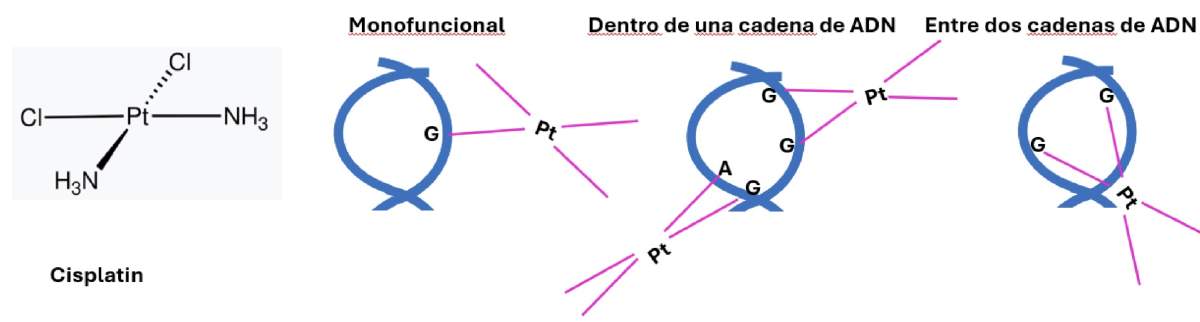
Figura 1. La estructura de Cisplatino y su interacción con cadenas de ADN. Izquierda, la estructura del Cisplatino (tomada de https://en.wikipedia.org/wiki/Cisplatin). Restantes figuras, tres maneras de interacción del cisplatino con las cadenas de ADN (en azul). G, guanina, A, adenina. Los esquemas de la interacciones se dibujaron con información publicada en (6).
Conscientes de esta necesidad, el Dr. Víctor Ivanov y el autor de este artículo, trabajando en el Instituto de Química General e Inorgánica de Academia de Ciencias de Unión Soviética, decidimos estudiar si el cisplatino afectaba el crecimiento de las raíces de las plantas, empleando las raíces del maíz y el pepino como sistemas modelo. ¿Por qué usar el crecimiento de la raíz como ensayo para identificar compuestos para combatir el cáncer en humanos?
Por qué usar plantas como objeto de estudio para ver efecto de diferentes compuestos
Se conoce desde hace mucho tiempo que el crecimiento de las raíces de plantas es muy sensible al tratamiento con diferentes compuestos químicos. Esto se debe a que el crecimiento de la raíz depende de la producción de nuevas células en una región en las puntas de la raíz, llamadas el meristemo apical, donde células se dividen y mantienen actividad proliferativa. Antes de que la raíz inicie su crecimiento a lo ancho, todas las células de eje de la raíz se multiplican en el meristemo apical y después de dividirse de cinco a siete veces, estas células inician un alargamiento (elongación) rápido, aumentando su tamaño de 20 a 30 veces. Ambos procesos, tanto la división celular como la elongación rápida, son muy sensibles a la aplicación de compuestos externos. Por eso, sabiendo como crece la raíz es posible predecir como actúa uno u otro compuesto.
La lógica es simple: si la raíz de una planta se expone a un compuesto citostático (un compuesto que impide la división celular), se afectará su crecimiento de una manera diferente a cuando se expone a un compuesto citotóxico (que tiene un efecto dañino, pero no bloquea la división celular por completo). Entonces, analizando la dinámica de crecimiento de la raíz en una solución es posible predecir si un compuesto es citostático o citotóxico.
En nuestros experimentos empleamos plantas de maíz creciendo en soluciones de compuestos diferentes a concentraciones variables, midiendo la longitud de la raíz durante cuatro días. Por ejemplo, cuando el nivel de inhibición de crecimiento de la raíz al día tres era mucho mayor que durante el primer día, lo clasificábamos como un efecto citostático, ya que la producción celular ya estaba fuertemente afectada. Sin embargo, si el grado de inhibición al tercer día era el mismo que durante el primer día, lo clasificábamos como un compuesto citotóxico, ya la raíz sigue creciendo debido a un bloqueo incompleto de la división celular (3).
La facilidad y economía en el uso de plantas para identificar compuestos era una gran ventaja. Preparar las plantas y hacer el experimento tomaba solamente una semana. En comparación, para probar un compuesto en animales, era necesario mantener ratones en bioterio, cultivar células cancerígenas, injertar los tumores a los animales vivos, mantener los animales y luego sacrificarlos para analizar el efecto. Entonces, el trabajo de prueba de compuestos usando animales toma varios meses de experimentación y por lo tanto es mucho más costoso. Usando el crecimiento de la raíz como sistema de búsqueda de compuestos activos, encontramos una correlación muy alta entre efecto de los compuestos (citostáticos o citotóxicos) tanto en plantas como en animales. Los compuestos descubiertos por su efecto citostático usando los ensayos de raíz fueron siempre anticancerígenos muy efectivos en animales. En el laboratorio del Dr. Ivanov pudimos probar en plantas más de 1000 compuestos, llevando al descubrimiento y patentamiento de nuevos compuestos con efecto citostático, potencialmente útiles para el tratamiento del cáncer en humanos (4).
¿Qué hay en común en el efecto de un citostático como inhibidor de tumores y el crecimiento de la raíz?
El cisplatino descubierto por Rosenberg es un citostático clásico, aunque también puede ser citotóxico. Es decir, los compuestos solamente citotóxicos no tienen efecto citostático, pero los compuestos citostáticos suelen tener ambos efectos. Por ejemplo, el mismo Cisplatino tiene efecto de hepato-toxicidad (tóxico para hígado), nefro-toxicidad (tóxico para riñones), cardio-toxicidad y otros (5).
Los compuestos citostáticos tienen la capacidad de atacar la división celular de los tumores debido a que se unen fuertemente al ADN, formando una unión covalente (Figura 1). Al unirse así inhiben la síntesis del ADN, impidiendo que las células se dividan de manera normal (6). En caso del cisplatino, esta inhibición se da por la unión del cisplatino con las bases nitrogenadas del ADN, específicamente con las purinas (guanina o adenina). El cisplatino puede formar unión con una sola base nitrogenada (unión mono funcional), o con dos bases dentro de la misma cadena, o entre diferentes cadenas de ADN (Figura 1), impidiendo en todos los casos la duplicación del ADN. La duplicación es esencial para formar nuevo material genético, que será segregado a las dos células hijas durante la división celular. Por eso el cisplatino es un medicamento potente que se usa en quimioterapia, a pesar de su efecto citotóxico.
La constancia en los procesos de duplicación del ADN, debido a antepasados evolutivos comunes entre plantas y animales, hace que el cisplatino tenga el mismo efecto en ambos grupos. Esto permite usar a las raíces de las plantas para la búsqueda de nuevos compuestos con mecanismos de acción similares, pero menos tóxicos. El hecho establecido que los citostáticos interactúan con el ADN, impulsó el buscar un sistema de ensayo en las plantas aún más simple que el análisis de la dinámica de crecimiento de la raíz. Para ello, hemos empleado a las plantas de pepino.
¿Por qué usar plantas de pepino?
Todas las plantas tienen un sistema de raíces, que son importantes para cumplir con funciones de captación y transporte de agua y compuestos minerales a la parte aérea (tallo, hojas, flores). Cualquier raíz puede formar nuevas raíces, llamadas raíces laterales. Entonces, la idea fue encontrar una especie vegetal que tenga semillas con capacidad de germinación rápida y que desarrollaran raíces laterales muy pronto después de la germinación. Una búsqueda nos llevó a encontrar que las plantas de la familia de calabazas (Cucurbitáceas) tienen estas características. Encontramos que, en esta familia de plantas, las semillas de pepino germinan muy fácil y tan solo en dos a tres días después de germinación forman ya raíces laterales, que emergen a partir de la raíz primaria (Figura 2A). Además, mi estudio demostró que la razón por la que el pepino forma raíces laterales tan rápidamente es debido a que tienen primordios de las raíces laterales ya formados desde el embrión, que no tienen todas las plantas (7).
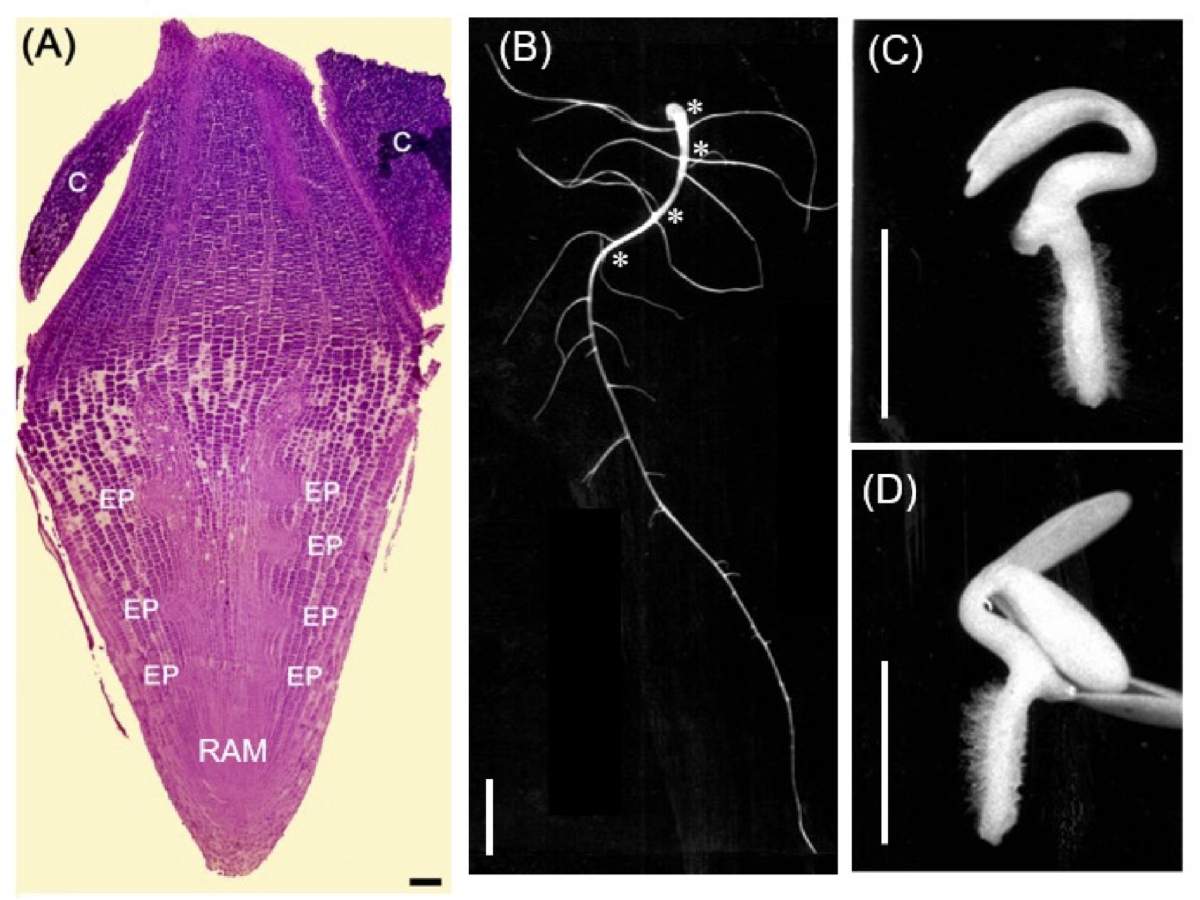
Figura 2. Plantas de pepino (Cucumis sativus) como objeto de estudio de efectos citostáticos de compuestos químicos. (A) Embrión maduro de la planta de pepino. RAM, meristemo apical de la raíz; EP, primordios embrionarios de las raíces laterales; C, cotiledones. (B) La raíz de plántula de pepino sin tratamiento, 4 días después de germinación. Noten que primeras cuatro agrupaciones de raíces laterales que crecen a partir de la raíz primaria son raíces laterales de origen embrionario (marcados con asteriscos). (C) y (D) plántulas de la misma edad tratadas con 10 µg/ml de Cisplatino diluido en agua (C) y plántulas germinadas en agua a partir de semillas irradiadas con rayos X a una dosis de 1000 Gray. Barra in (A) = 100 µm, (B)-(D) = 10 mm; 1000 µm corresponde a 1 mm (Imágenes modificadas tomadas de (7, 8, 12).
Estos primordios de las raíces laterales ya están muy bien desarrollados y después de la germinación las primeras raíces laterales emergen a partir de estos (Figura 2B). Encontramos que cuando crecemos las plántulas de pepino en una solución de cisplatino, la raíz primaria emergida no puede crecer, y las raíces laterales no emergen (Figura 2C). Esto ocurre porque las células de los primordios embrionarios de las raíces laterales se detienen en su crecimiento, ya que pierden la capacidad de división celular (8). Es interesante que este efecto es muy similar a los efectos de la radiación con rayos X, la cual también impide la proliferación celular. Cuando las semillas de pepino se irradian con una dosis muy alta de rayos X (1000 Grey), las células de la plántula no mueren inmediatamente, la raíz primaria emerge, pero no puede crecer y tampoco se desarrollan las raíces laterales (Figura 2D). El cisplatino es entonces un compuesto radio mimético (con el mismo efecto de los rayos X).

Figura 3. Efecto de diferentes compuestos sobre el crecimiento de las raíces de pepino. Cuadrado verde, plántulas desarrolladas a partir de semillas germinadas en agua. Rectángulos rojos, plántulas desarrolladas a partir de semillas germinadas en soluciones de citostáticos diluidos en agua. Todas las concentraciones están en microgramos por mililitro. b, Cisplatino 4; c, Mitomicina 50; d, 8-azaguanina 100; e, cloranfenicol 50. Rectángulos naranja, indican plántulas desarrolladas a partir de semillas germinadas en soluciones de citotóxicos diluidos en agua. f, 5-aminouracilo 2000; cicloheximida 5; h, D,L-Etionina 500; i, Nitrato de cadmio Cd(NO3)2, 100; j, Cloruro de mercurio HgCl2 100; Sulfato de cobre CuSO4, 100; l, Sulfato de talio 25, 50, 100. Reproducido de (9) con modificaciones.
Estos hallazgos nos llevaron a proponer un ensayo más rápido, fácil y simple para la búsqueda de un efecto citostático en compuestos cuyo efecto no era conocido aún (9). Encontramos que cuando las semillas de pepino germinan en una solución conteniendo citostáticos, como Cisplatino, Mitomicina, 8-Azaguanina (análogo de guanina), y cloranfenicol (inhibidor de síntesis de proteínas), las raíces laterales no se desarrollan, y solo la radícula embrionaria que desarrolla la raíz primaria está presente (Figura 3, fotos rodeadas por una línea roja). Cuando las plántulas de pepino crecen en presencia de compuestos extremadamente tóxicos, como las sales de Talio (Tl) o mercurio (Hg), la raíz crece pobremente, pero aun así no se inhibe la emergencia de las raíces laterales (Figura 3, fotos rodeadas por una línea naranja).
Posibles aplicaciones futuras de ensayos empleando raíces
Como en la punta de la raíz se forma el meristemo apical (Figura 2A), que contiene grupos de células con alta capacidad de división celular y se dividen rápido, estas son muy sensibles a cualquier compuesto ajeno. Como se describió arriba, esto fue una de las razones de uso de raíces para ensayos de detección y clasificación de su efecto (citostático o citotóxico). También, debido a la alta capacidad de división celular en los meristemos, la raíz se usa en ensayos para detectar si otros compuestos tienen un efecto cancerígeno, ya que algunos compuestos pueden inducir aberraciones cromosómicas y daño al ADN, afectando la cantidad de las células que entran en división celular (índice mitótico), características cruciales para el desarrollo de cánceres. Los ensayos con las raíces son también de gran utilidad para estudios de toxicología ambiental, para detectar efectos de compuestos contaminantes, metales pesados, colorantes industriales, herbicidas, y otros en el medio ambiente (10, 11). Debido a que los mecanismos de daño a ADN, puntos de verificación del ciclo celular y división celular están conservados entre plantas y animales (12), el uso de la raíz en ensayos ofrece un método rápido, barato, y éticamente apropiado.
Referencias
- Romero Camarena, David (2025). ¡Qué curioso! La Unión de Morelos, 22 de junio de 2025. https://acmor.org/publicaciones/qu-curioso
- Rosenberg B, Van Camp L, Krigas T. Inhibition of cell division in Escherichia coli by electrolysis products from a platinum electrode. Nature 1965, 205:698-699.
- Ivanov V. Using the roots as test objects for the assessment of biological action of chemical substances. Russian Journal of Plant Physiology 2011, 58:1082-1089.
- Obroucheva N. To the 70th birthday of Viktor B. Ivanov. Russian Journal of Developmental Biology, 2007, 38:329–331.
- Tchounwou PB, Dasari S, Noubissi FK, Ray P, Kumar S. Advances in our understanding of the molecular mechanisms of action of cisplatin in cancer therapy. Journal of Experimental Pharmacology 2021, 13:303-328.
- Eastman A. The mechanism of action of cisplatin: from adducts to apoptosis. Cisplatin: Chemistry and biochemistry of a leading anticancer drug, Ed. By B. Lippert, Zurich 1999:111-134.
- Dubrovsky JG. Origin of tissues of embryonic lateral root in the cucumber, tissue interactions, and positional control in development. Ontogenez 1986, 17:176-189 (La traducción al inglés del original en ruso apareció en el Soviet Journal of Developmental Biology, New York, N.Y., Consultant Bureau 117:119-128).
- Dubrovsky JG. Radiomimetic effect of cisplatin on cucumber root development: the relationship between cell division and cell growth. Annals of Botany 1993, 72:143-149.
- Ivanov VB, Bystrova EI, Dubrovsky JG. Cucumber seedlings as test object for discovering effective cytostatics. Soviet Plant Physiology, 1986, 33:158-161. (Traducido de Fiziologiya Rastenii, Moscú)
- Grant WF. Higher plant assays for the detection of genotoxicity in air polluted environments. Ecosystem Health 1998, 4:210-229.
- Leme DM, Marin-Morales MA. Allium cepa test in environmental monitoring: a review
on its application. Mutation research/reviews in mutation research 2009, 682:71-81.
- Dubrovsky JG, Laskowski M. Lateral Root Initiation. In Encyclopedia of Applied Plant
Sciences (Second Edition). Edited by Murray BG, Murphy DJ: Academic Press; 2017:256-264.
Esta columna se prepara y edita semana con semana, en conjunto con investigadores morelenses convencidos del valor del conocimiento científico para el desarrollo social y económico de Morelos.


