La Dra. Campos Viguri es Químico Biólogo Parasitólogo, con Maestría y Doctorado en Ciencias Biomédicas por la Universidad Autónoma de Guerrero. Su área de investigación es la regulación de genes por mecanismos epigenéticos asociados al desarrollo de cáncer. Es investigadora en el CICATA Unidad Morelos del Instituto Politécnico Nacional.
El Dr. Mondragón Terán es Ingeniero Bioquímico por el Instituto Tecnológico de Zacatepec, con Maestría en Biotecnología por el Tecnológico de Monterrey Campus Monterrey y Doctorado en Ciencias (PhD) en Medicina Regenerativa por el University College London – Reino Unido. Su área de investigación es el uso de células troncales aplicadas a medicina regenerativa e ingeniería de tejidos, bioprocesos, generación de vasos sanguíneos y de células CAR-T, estudio de cáncer, entre otros. Es Director del CICATA Unidad Morelos del Instituto Politécnico Nacional e integrante de la Academia de Ciencias de Morelos, A. C.
Esta publicación fue revisada por el comité editorial de la Academia de Ciencias de Morelos.
¿Alguna vez te has preguntado cómo hacen los arqueros para no fallar? Estudian a fondo su objetivo y afinan su puntería para acertar al blanco con precisión. Algo parecido pasa con la oncología de precisión: los investigadores analizan cómo funcionan los tumores para atacar puntos clave y eliminar el cáncer. Para lograrlo, llevan sus descubrimientos al campo médico y ajustan sus métodos conforme avanzan. Este proceso de estudio, adaptación y aplicación a la clínica, se conoce como medicina traslacional (1).
Desde siempre los descubrimientos del laboratorio se han aplicado a la clínica, solo basta pensar que, del desarrollo hasta el uso de vacunas, antibióticos y otros tratamientos, ha habido algún nivel de “traslación”. Sin embargo, el interés concreto y organizado de conectar la ciencia básica con la práctica clínica se dio entre los siglos XX y XXI. Como resultado de ello, surgieron centros de investigación en todo el mundo, incluido México (Figura 1), que a la fecha siguen orientados o se redireccionaron a la medicina traslacional. En este artículo abordaremos los logros, retos y oportunidades más actuales de la medicina traslacional y su impacto en la oncología de precisión.
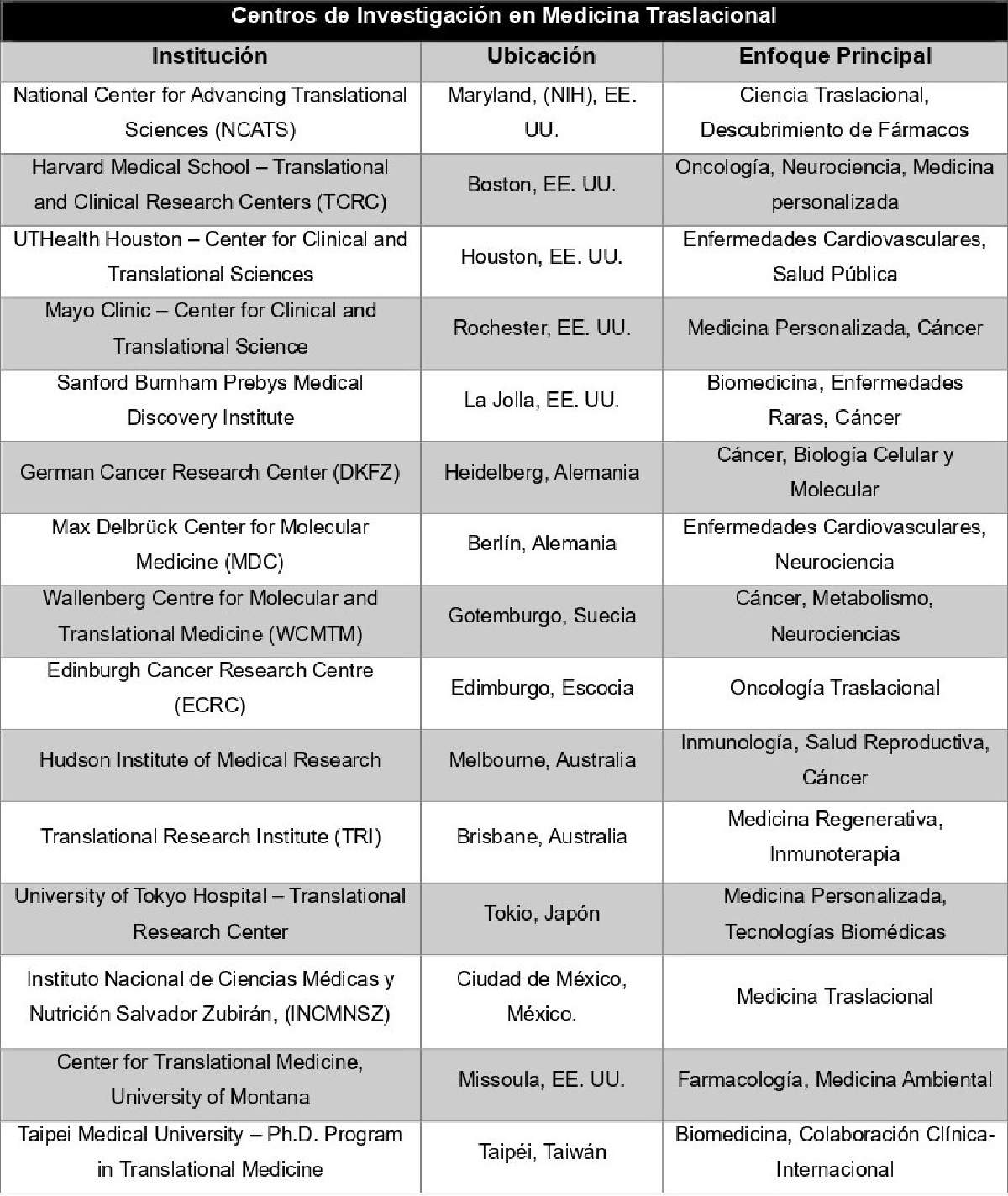
Figura 1. Principales centros de investigación en Medicina Traslacional. La mayoría están altamente consolidados, salvo el Center for Translational Medicine en Missoula y la Taipéi Medical University, que tienen consolidación media.
Logros de la medicina traslacional
- Desarrollo de estrategias terapéuticas personalizadas y dirigidas: Medicina de precisión
El planteamiento de tratamientos individualizados surgió cuando los diagnósticos incluyeron la identificación de cambios moleculares únicos en el material hereditario de tumores individuales, orillando a que las estrategias centradas en órganos, evolucionaran a estrategias personalizadas y dirigidas a un objetivo “preciso”. Esta evolución ha mejorado la calidad de vida de los pacientes con cáncer, superando los efectos secundarios de los tratamientos convencionales que, al no ser específicos, deterioran al paciente y dificultan su recuperación (2).
Gran parte de la medicina de precisión para el cáncer funciona como el juego de “quemados”: identifica proteínas clave en las células cancerosas, y cuando las “toca” con terapias específicas (anticuerpos o inhibidores), las inactiva, impidiendo que el cáncer avance. A veces las terapias específicas pueden “reforzar” los tratamientos convencionales, considerándose terapias coadyuvantes, permitiendo así, tanto la reducción de las dosis de los fármacos iniciales como de los efectos secundarios. En 2003, la agencia de Administración de Alimentos y Medicamentos de EE. UU. (FDA, por sus siglas en inglés) aprobó el Toripalimab (Loqtorzi), un fármaco coadyuvante que bloquea la proteína PD-1, haciendo que el sistema inmune vuelva a reconocer al cáncer como una amenaza; este medicamento está indicado en el tratamiento del carcinoma nasofaríngeo recurrente o metastásico (con alcance a otros tejidos y órganos). En lo que va del 2025, la FDA ha aprobado cuatro fármacos específicos. Uno de ellos es el anticuerpo Datopotamab deruxtecan (Datroway) para tratar el cáncer de mama metastásico o no resecable (sin posibilidades de ser extirpado) tras quimioterapia. También se aprobaron los inhibidores Vimseltinib (Romvimza) y Mirdametinib (Gomekli) para tratar tumores tenosinoviales gigantes y la Neurofibromatosis tipo 1 no resecables, respectivamente. Por último, se aprobó el Treosulfan (Grafapex) que aminora el rechazo de los trasplantes hematopoyéticos en pacientes con leucemia mieloide aguda o síndrome mielodisplásico. Seguramente en un futuro, más estudios clínicos se concluyan y la cartera de biofármacos aprobados para cáncer se amplíe, lo que reduciría significativamente las muertes por esta enfermedad.
- Diagnósticos más rápidos y precisos
Para el humano, la certeza consiste en adherirse a algo que conoce, sin posibilidad de error, y cuando se habla de cáncer, existe una profunda necesidad de certeza en los diagnósticos. La identificación de “señales” moleculares específicas de cáncer y las evaluaciones clínicas minuciosas de los pacientes, han aumentado la certeza y agilidad de los diagnósticos oncológicos y de otras enfermedades. Por ejemplo, hoy es posible detectar mutaciones en los genes BRCA1 y BRCA2 asociadas al riesgo de desarrollar cáncer de mama, lo que podríamos llamar “predisposición genética al cáncer”. La gran ventaja es que estas mutaciones pueden detectarse antes de que los signos clínicos del cáncer aparezcan. Esto permite vigilar a la paciente y evaluar el riesgo de cáncer en sus familiares cercanos, además de sugerir cambios en su estilo de vida, e incluso considerar cirugía preventiva, como en el caso de la actriz Angelina Jolie. Sin embargo, las decisiones médicas derivadas de este y otros métodos diagnósticos, deben considerar aspectos clínicos y éticos en pro del bienestar de la paciente.
- Desarrollo de vacunas innovadoras
La prevención también es un objetivo de la medicina traslacional, tanto que en esta área se han dado grandes avances, como el desarrollo de vacunas innovadoras. Por ejemplo, en 2006 se aprobó la vacuna contra el Virus del Papiloma Humano (VPH), Gardasil, para brindar protección a personas entre los 9 y 26 años contra cuatro genotipos de VPH (dos asociados al desarrollo de cáncer cervical); después, en 2014, se aprobó una nueva versión, Gardasil-9, que protege contra nueve genotipos de VPH (siete asociados a cáncer cervical) y que hoy se aplica en personas entre los 9 y 45 años. Con respecto a otras enfermedades, en 2019 la FDA aprobó la vacuna contra el virus Ébola (rVSV-ZEBOV-Ervebo), para contener los brotes en África. En 2020, durante la pandemia de COVID-19, fue urgente el diseño y aprobación de vacunas de RNA mensajero -RNAm- aptas para uso humano, Comirnaty (Pfizer-BioNTech) y Spikevax (Moderna). El RNAm contenido en estas vacunas permite generar una parte del virus (por ejemplo, la proteína "Spike", de la superficie del virus) con la que se inmunizó a las personas. La vacuna RST,S contra la malaria, creada en 1987 y que en 2019 comenzó su implementación piloto en países endémicos, también es un fruto de la medicina traslacional.
Un desarrollo que no deja de sorprender, es el de vacunas personalizadas para prevenir o tratar el cáncer. Algunas usan la información genética del tumor, mientras que otras, como Provenge® (sipuleucel-T), funcionan como inmunoterapia autóloga. Provenge® se ha probado con éxito en cáncer de próstata, y comprende la obtención de células inmunitarias del propio paciente que “se entrenan en el laboratorio” para reconocer a una proteína del tumor y luego se regresan al paciente, para potenciar su respuesta inmune anti-tumoral. Aunque aún falta investigación, es claro que la prevención y tratamiento del cáncer mediante vacunas, representa un enfoque novedoso en la oncología de precisión.
- Modelos animales humanizados y organoides
La necesidad de comprender íntimamente las enfermedades ha llevado a replantear los modelos tradicionales para su estudio en el laboratorio. Actualmente hay modelos que simulan las enfermedades, para estudiar las células afectadas y su entorno (microambiente). Uno de estos modelos son los animales humanizados, que resultan de modificar genéticamente animales de experimentación, para recrear microambientes humanos completos, con todo y sus redes de comunicación. Estos modelos serían como el Indominus rex en la película Jurassic World (2015). Como muestra de su impacto en investigación, sabemos que los ratones humanizados con ACE2, ayudaron a la identificación de la proteína ACE2 como puerta de entrada del virus SARS-CoV-2; y que los ratones transgénicos HLA, son usados para reproducir y estudiar enfermedades autoinmunes humanas.
Además, hoy en día hasta es posible recrear órganos que evitan la experimentación en animales. Los llamados organoides son una especie de órganos humanos réplica en miniatura creados a partir de células madre y desarrollados en el laboratorio para estudiar procesos biológicos normales y patológicos. Por ejemplo, los organoides cerebrales generados por células pluripotenciales, son útiles en el estudio del neurodesarrollo, el autismo y la microcefalia; con los organoides intestinales desarrollados a partir de células madre de criptas intestinales, se estudia la enfermedad inflamatoria intestinal y la absorción de fármacos; y desde la perspectiva oncológica, los organoides de mama generados de biopsias tumorales (tumoroides), se usan en la evaluación de terapias oncológicas personalizadas. Estos modelos son recursos valiosos para el estudio integral de las enfermedades.
Todos estos grandes avances (Figura 2) no ocurrieron de la noche a la mañana, implicaron años de investigaciones exhaustivas, múltiples retos, y la integración de conocimientos básicos y clínicos (2). Evidentemente la medicina traslacional seguirá siendo un campo rico en nuevos retos y oportunidades, prácticamente un rompecabezas en construcción.
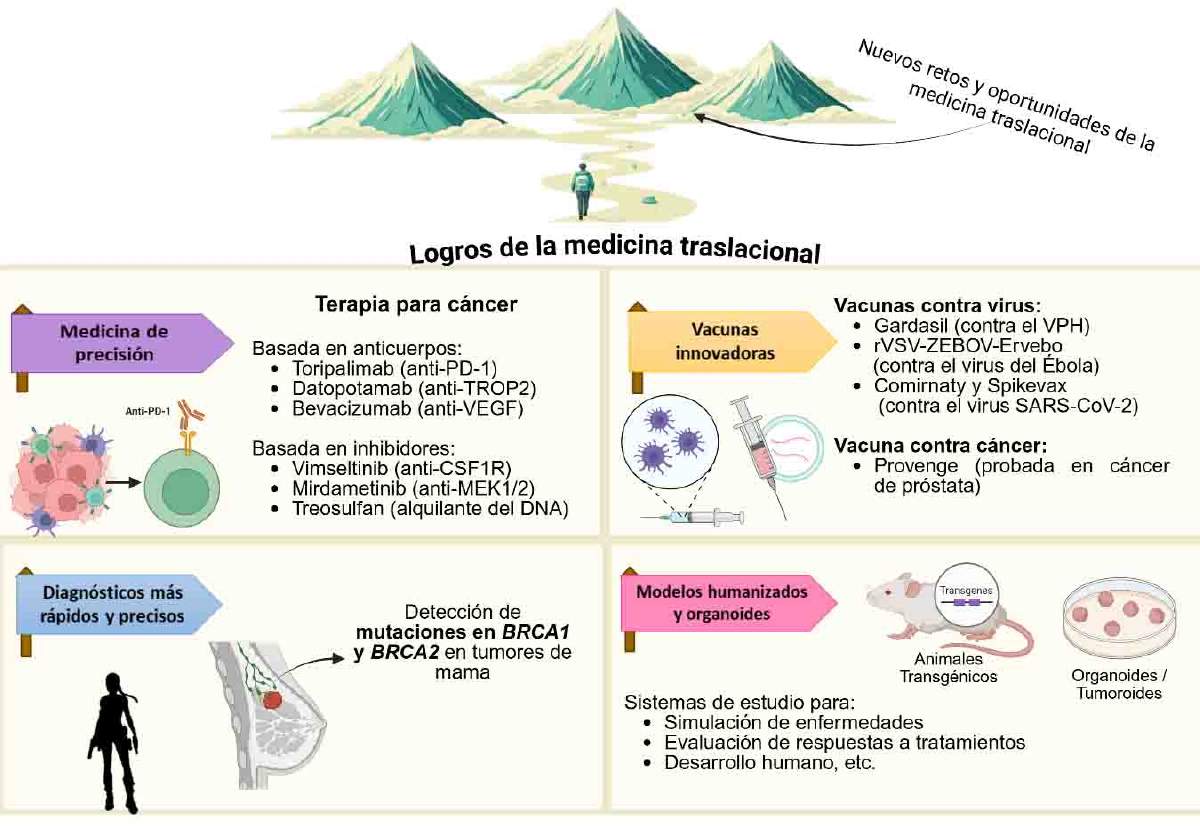
Figura 2. Avances y aplicaciones actuales de la Medicina Traslacional. Abreviaturas: PD-1, Proteína de muerte celular programada; TROP2, Antígeno de superficie de trofoblasto 2; VEGF, Factor de crecimiento endotelial vascular; CSF1R, Receptor del factor estimulante de colonias 1; MER1/2, Proteína quinasa activada por mitógenos; BRCA1/2, Proteína de susceptibilidad a cáncer de mama tipo 1 y 2; Alquilante de DNA, Agente que se une al DNA e interfiere en su síntesis. Imagen creada con elementos de Pinterest y editada en el programa Biorender (https://www.biorender.com/).
Retos de la medicina traslacional
- Brecha entre investigadores básicos y clínicos
La falta de comunicación entre investigadores básicos y clínicos, es un freno en la transferencia de conocimientos. Imaginemos que un científico descubre una molécula que elimina un tumor maligno en ratones y publica sus hallazgos en una revista especializada. Posteriormente, un oncólogo lee sobre su trabajo y aunque reconoce el valor de la molécula, no puede aplicarla en la clínica, porque no existe evidencia de su uso seguro en humanos. Al final, y al igual que pasa con muchos descubrimientos “prometedores”, la molécula queda “estancada”, sin avanzar a un medicamento real. Este escenario ejemplifica la falta de comunicación entre investigadores básicos y clínicos, y aunque no es imposible conectar ambos mundos, se necesita de un esfuerzo mutuo, después de todo, la medicina traslacional es un “trabajo conjunto” para que los descubrimientos de hoy, sean los tratamientos de mañana.
- Falta de financiamiento y costos elevados de la investigación y desarrollo traslacional
Como es de imaginarse, las ventajas económicas “agilizan la reconfiguración” de diagnósticos, tratamientos y prevención de enfermedades. En oncología, esta reconfiguración suele ser muy costosa; tan solo entre 1997 y 2020, generar un medicamento contra el cáncer costó en promedio 4,400 millones de dólares, y claro, esta cifra varió dependiendo del fármaco. Aunque se ha indicado que los medicamentos oncológicos de precisión podrían ser mil millones de dólares más baratos de desarrollar que los de no precisión (3), para alcanzar esto, se necesitaría de la acción conjunta de los sectores público y privado, apoyados por los gobiernos de cada latitud geográfica; un escenario que sigue siendo un reto lejano en países en desarrollo.
- Fallas en los ensayos clínicos: falta de replicabilidad y validación
Cualquier producto requiere de evaluaciones minuciosas antes de ser comercializado y consumido, y esto no es diferente para los desarrollos traslacionales. Para que un fármaco se apruebe, se requiere probar cientos de moléculas en evaluaciones preclínicas (en modelos celulares y animales) y clínicas (en humanos) robustas, que forzosamente deben ser repetibles (replicables) para apoyar su validación. La replicabilidad es un reto de la medicina traslacional, pues controla la validación y aprobación de sus productos. Un caso representativo de cómo las fallas en la reproducibilidad (entre modelos o fases de evaluación), impactan en la validación de los productos traslacionales, se observó con las terapias antioxidantes. Si bien en el laboratorio estas terapias reducen el daño oxidativo asociado a cáncer, han fracasado en ensayos clínicos: se ha visto que el uso de antioxidantes como la vitamina E o el beta-caroteno, lejos de prevenir cáncer, aumentan el riesgo de desarrollarlo en fumadores (4, 5). Esto remarca la premisa de que lo que protege a células individuales, no necesariamente beneficia a organismos humanos completos.
- Barreras regulatorias y éticas
Para garantizar que las invenciones traslacionales sean seguras, eficaces y de alta calidad, es indispensable su valoración por agencias regulatorias y comités de ética. Para ello, es necesario que estas invenciones pasen evaluaciones preclínicas y clínicas, en las cuales, los investigadores básicos y clínicos deben proceder con incorruptibles principios bioéticos. Por lo tanto, aunque el proceso de aprobación es complejo, largo, costoso y altamente controlado, es necesario para garantizar medicamentos eficaces y confiables para los pacientes.
- Infraestructura insuficiente en países en desarrollo
Sabemos la madurez económica de un país es clave para realizar investigación, desarrollar y aplicar la medicina traslacional. Por ello, es inevitable pensar que en países subdesarrollados el panorama se dificulta, pues si de por sí la falta de inversión económica limita la investigación básica, ni pensar en el desarrollo de infraestructura adecuada para su evaluación clínica. Este es un tema que resuena en México, donde a pesar de haber productos prometedores de la investigación básica, éstos atraviesan un “cuello de botella” al no haber suficiente infraestructura para su evaluación clínica y posterior aplicación rutinaria.
- Acceso desigual a la innovación médica: población vulnerable
Si pensamos en desigualdades en el acceso a la innovación, quizás de inmediato se nos venga en mente que, en la pasada pandemia, la distribución de las vacunas contra el COVID-19 no fue igual en todos los países; aquellos con más desarrollo promovieron la vacunación inmediata de su población, mientras que la vacunación en países subdesarrollados, dependió (en muchos casos) de “donaciones”. Por otro lado, no es un secreto que el diagnóstico genético del cáncer es prácticamente un mito en zonas rurales o marginadas; y que la accesibilidad a tratamientos de última generación (terapias de precisión) para esta enfermedad, está concentrada en centros especializados de países desarrollados, dejando sin cobertura a millones de pacientes (6). Estas disparidades magnifican la brecha en la atención médica entre países y el común denominador es la economía de cada nación.
Oportunidades de la medicina traslacional
- Análisis masivo de datos e inteligencia artificial
Imaginemos que estamos frente a una mina poco explorada, pero con un gran potencial mineral, seguramente buscaríamos la manera de saber qué minerales hay dentro y cómo aprovecharlos de la mejor manera. Lo mismo sucede con las grandes masas de datos genómicos y clínicos obtenidas de investigaciones dirigidas y que, generalmente, forman parte de “racimos” más grandes de datos similares de varias poblaciones (reservorios bioinformáticos globales). El análisis de estos datos, ofrece la oportunidad de desarrollar modelos de predicción de respuestas personalizadas a preguntas clínicas individuales. Pero, como en el ejemplo de la mina, ¡qué difícil sería obtener y analizar datos bioinformáticos globales a pala y pico! Para ello actualmente se han desarrollado sistemas apoyados en inteligencia artificial (IA) que asimilan los datos y arrojan las posibles “rutas” para su aplicación (7). Tanto el análisis masivo de datos como la IA, son enormes oportunidades para que la medicina traslacional avance de forma ágil y con soporte.
- Colaboraciones interdisciplinarias
Para que la medicina traslacional logre que los descubrimientos científicos se posicionen como soluciones clínicas concretas, se vale de la integración de conocimientos mediante colaboraciones interdisciplinarias. Por lo tanto, una de sus áreas de oportunidad es la creación de redes de especialistas de diversos campos, con el fin de acelerar o innovar diagnósticos, tratamientos y tecnologías médicas, y así, acortar la distancia entre el laboratorio y el paciente.
- Participación activa del paciente
¿Serán importantes la opinión y participación de los propios pacientes sobre las innovaciones traslacionales que los podrían curar de sus padecimientos? Por supuesto que sí, hoy hay un gran reflector sobre las experiencias, prioridades, necesidades y visión de los pacientes, pues orientan las innovaciones hacia un impacto real. Entonces la fórmula “ciencia + tecnología + vivencia humana”, además de empoderar a los pacientes, representa una gran área de oportunidad que, al ser explotada, puede garantizar que los avances ayuden verdaderamente a quienes más los necesitan.
- Diseños innovadores de ensayos clínicos
Hay puntos durante la investigación traslacional que pueden reconfigurarse o rediseñarse. Un ejemplo de ello son los ensayos clínicos adaptativos desarrollados en el área oncológica (8) que, a diferencia de los ensayos tradicionales, permiten evaluar múltiples tratamientos simultáneamente, adaptando protocolos según sus resultados en tiempo real, tal como una receta a la que necesitas ir “checando” la cantidad de sal en todo momento. Entre las ventajas que brindan estos ensayos está su flexibilidad, su naturaleza interdisciplinaria y la participación activa de los pacientes. La comunión de estos elementos es una oportunidad que no solo optimiza los recursos y tiempo, sino que coloca al paciente en el centro del proceso, haciendo a la medicina traslacional más ágil, precisa y humana.
Estos son algunos ejemplos de los retos y oportunidades de la medicina traslacional (Figura 3), pero debemos recordar que los avances logrados a la fecha, no están exentos de reconfigurarse.
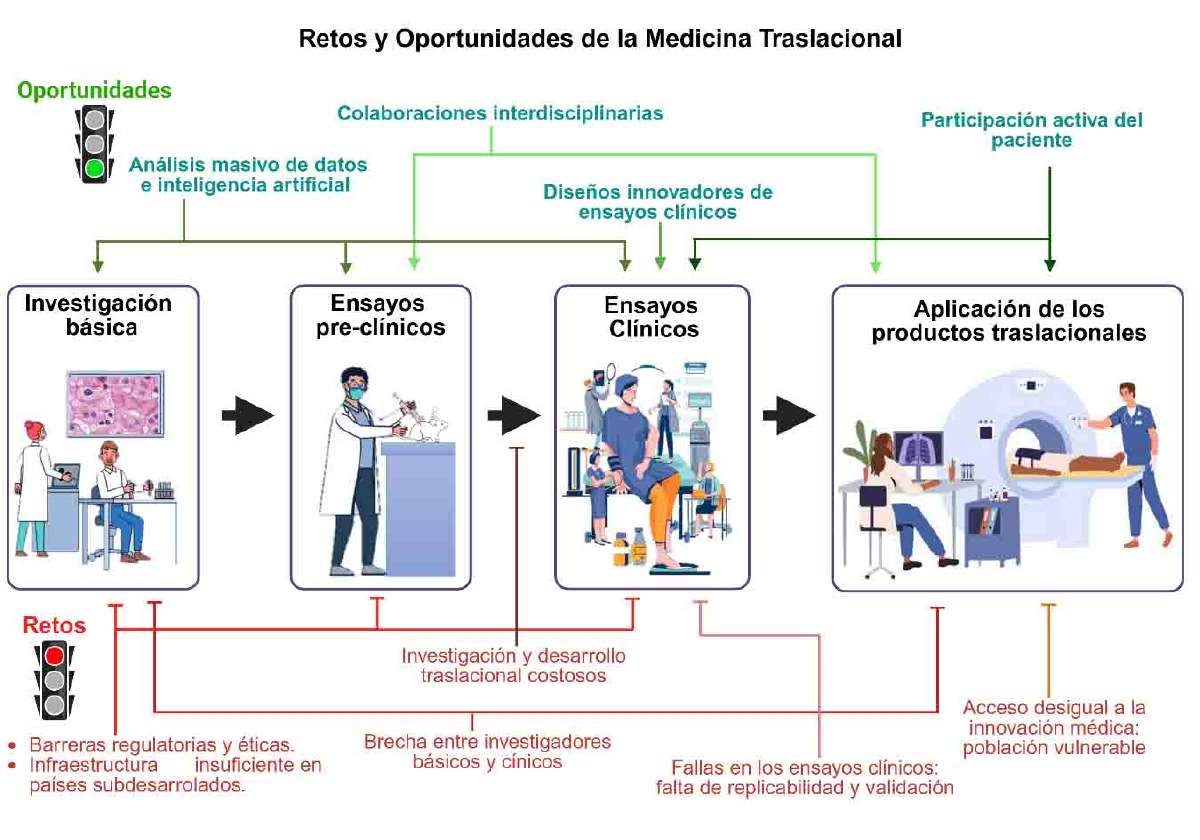
Figura 3. Retos y oportunidades de la medicina traslacional. En verde se marcan las áreas de oportunidad de la investigación traslacional; en rojo se marcan los obstáculos de este campo médico. Imagen creada con elementos de Pinterest y editada en el programa Biorender (https://www.biorender.com/).
Conclusiones
Pese a que la medicina traslacional se dirige a traducir los descubrimientos científicos hacia mejoras tangibles para la salud humana, también se ha preocupado por generar sistemas que optimicen recursos y tiempo para buscar estas mejoras. Su impacto va desde la búsqueda de marcadores específicos de enfermedad y el replanteamiento de modelos para su estudio, hasta la reconfiguración de ensayos clínicos de aplicabilidad. Todo esto sin dejar de lado la construcción de enfoques críticos, adaptativos y resilientes que ayuden a enfrentar nuevos retos y a reconocer las oportunidades de crecimiento de la oncología de precisión y de otros campos biomédicos.
Referencias
- Hernández-Carrillo, et al. (2018). Investigación traslacional en ciencias de la salud: implicaciones educativas y retos. Investigación en educación médica, 7(28),85-97. https://doi.org/10.22201/facmed.20075057e.2018.28.18146
- Saeed, et al. (2023). Targeted Therapy and Personalized Medicine. Cancer treatment and research, 185, 177–205. https://doi.org/10.1007/978-3-031-27156-4_10
- Sullivan, R. (2023). Oncology drugs estimated to be $1 billion cheaper to develop through a precision approach. King's College London. https://www.kcl.ac.uk/news/oncology-drugs-estimated-to-be-1-billion-cheaper-to-develop-through-a-precision-approach
- Alpha-Tocopherol, et al. (1994). The effect of vitamin E and beta carotene on the incidence of lung cancer and other cancers in male smokers. The New England journal of medicine, 330(15), 1029–1035. https://doi.org/10.1056/NEJM199404143301501
- De Luca, L. M., & Ross, S. A. (1996). Beta-carotene increases lung cancer incidence in cigarette smokers. Nutrition reviews, 54(6), 178–180. https://doi.org/10.1111/j.1753-4887.1996.tb03926.x
- Drake, T. M., et al. (2018). Global Inequities in Precision Medicine and Molecular Cancer Research. Frontiers in oncology, 8, 346. https://doi.org/10.3389/fonc.2018.00346
- Sahu, M., et al. (2022). Artificial intelligence and machine learning in precision medicine: A paradigm shift in big data analysis. Progress in molecular biology and translational science, 190(1), 57–100. https://doi.org/10.1016/bs.pmbts.2022.03.002
- McGarry, A., & Kieburtz, K. (2023). Adaptive clinical trials and master protocols. Handbook of clinical neurology, 193, 313–323. https://doi.org/10.1016/B978-0-323-85555-6.00005-9
Esta columna se prepara y edita semana con semana, en conjunto con investigadores morelenses convencidos del valor del conocimiento científico para el desarrollo social y económico de Morelos.




