Josselyne Transito es Ingeniera en Nanotecnología y actualmente cursa el Doctorado en Ciencias Físicas en la Universidad Nacional Autónoma de México. Forma parte del Laboratorio de Biofísica del Instituto de Ciencias Físicas de la UNAM (ICF-UNAM), donde ha desarrollado proyectos sobre diseño y estudio de biomateriales para liberación controlada de fármacos.
Edith Alanis es bióloga egresada de la Facultad de Ciencias Biológicas de la UAEM. Actualmente cursa el Doctorado en Ciencias, con especialidad en Biología Celular y Molecular, en el IICBA. Su trayectoria incluye colaboraciones con el Instituto Nacional de Salud Pública (INSP) y el ICF-UNAM.
Claudia Arau es estudiante del séptimo semestre de la licenciatura en Farmacia de la UAEM. Actualmente realiza sus prácticas profesionales en el ICF-UNAM, donde colabora en proyectos enfocados a la evaluación de fármacos antifúngicos en levaduras.
Esta publicación fue revisada por el comité editorial de la Academia de Ciencias de Morelos.
Cada 11 de febrero, el Día Internacional de la Mujer y la Niña en la Ciencia invita a reconocer la participación femenina en el conocimiento científico y a reflexionar sobre las consecuencias de su exclusión histórica, con el objetivo de evitar que estas desigualdades se repitan en las nuevas generaciones.
La ciencia ha redefinido la manera en que entendemos el cuerpo humano; no obstante, este progreso no ha beneficiado por igual a toda la población. A pesar de que las mujeres representan más del 50 % de la población mundial, persiste una brecha que se manifiesta no sólo en los ámbitos laborales y académicos, sino también en uno de los espacios más críticos: la medicina.
¿Sabías que para muchas enfermedades, los criterios diagnósticos, la descripción de los síntomas e incluso las dosis prescritas de los medicamentos para tratarlas fueron definidos a partir de estudios realizados casi exclusivamente en poblaciones masculinas? Así es, el cuerpo masculino se consolidó como el modelo “neutral” de la biología humana, mientras que el cuerpo femenino ha sido considerado una variante compleja, hormonalmente inestable o incluso problemática.
En este artículo exploraremos cómo este sesgo de género en la investigación biomédica se normalizó como un estándar científico y cuáles han sido sus consecuencias en el estudio de enfermedades, el desarrollo de fármacos y la evaluación de su toxicidad para más de la mitad de la población, las mujeres.
El origen: la investigación biomédica de un solo sexo
¿Dónde están las ratonas? El sesgo por sexo en la medicina tiene su origen en las etapas tempranas de la investigación biomédica, particularmente en los estudios preclínicos. Durante gran parte del siglo XX y principios del XXI, los modelos animales utilizados en la farmacología, las neurociencias y la fisiopatología se basaron en ejemplares macho, principalmente ratones (Mus musculus) y ratas (Rattus norvegicus). Esta práctica se justifica metodológicamente por la presunta creencia de que el ciclo hormonal femenino hacía que los resultados fueran demasiado variables e impredecibles.
Esta exclusión en ensayos experimentales compromete la calidad de la ciencia y hace que sus resultados sean difíciles de aplicar al mundo real. Diversas investigaciones han revelado que, entre las décadas de 1990 y 2010, la ciencia se centró casi exclusivamente en modelos murinos machos [1]. Más del 70 % de los modelos animales empleados en laboratorios de áreas como neurobiología, inmunología, farmacología pertenecían a este sexo (Figura 1). En el caso de la neurociencia, parece que fue un evento aún más drástico, con más de cinco estudios con machos por cada estudio con hembras.
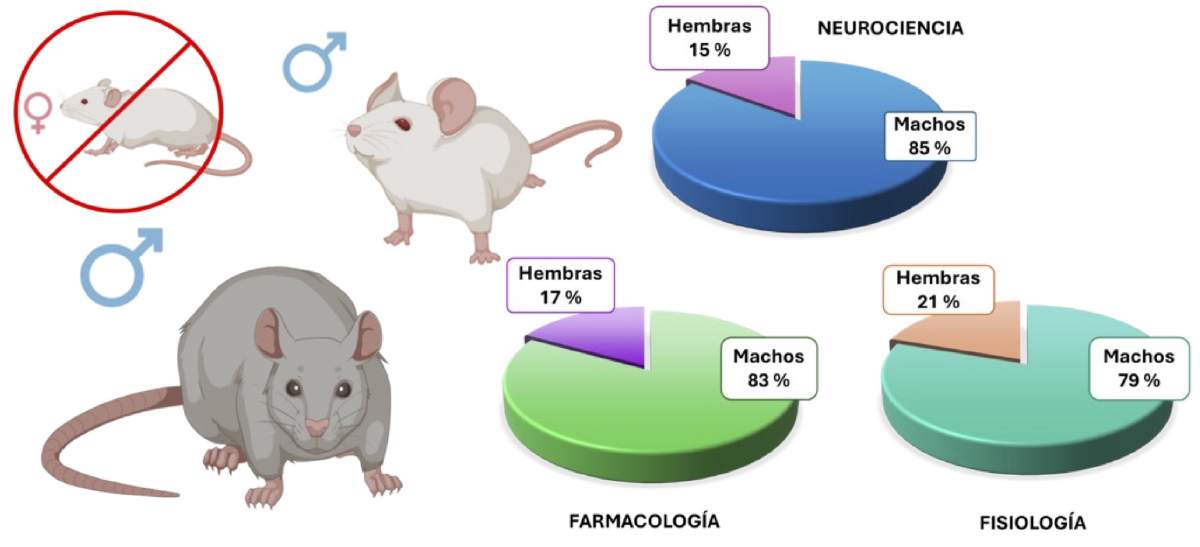
Figura 1. Distribución en el uso de animales macho y hembra para estudios preclínicos biomédicos. Datos basados en el análisis de publicaciones científicas de 2009 [1].
Por lo tanto, numerosos medicamentos aprobados y prescritos actualmente fueron evaluados mayoritariamente en hombres jóvenes, sanos y sin variaciones hormonales. Este desequilibrio experimental generó una base de conocimiento biomédico incompleta, en la que los mecanismos fisiopatológicos y las respuestas terapéuticas fueron extrapolados a poblaciones femeninas sin una validación biológica adecuada. A partir de 2014, organismos reguladores como Institutos Nacionales de Salud de los EE. UU. [2] establecieron lineamientos para la inclusión del sexo como variable biológica indispensable en la investigación preclínica, reconociendo formalmente que la omisión sistemática de hembras constituye una limitación metodológica crítica.
La dosis correcta en el cuerpo incorrecto
Esta exclusión de hembras en estudios sistemáticos resulta un problema cuando conocemos que las mujeres difieren de los hombres en múltiples aspectos biológicos relevantes para la farmacología: su composición corporal, la actividad enzimática hepática, su función renal y la respuesta inmunológica. A pesar de ello, durante años se utilizaron las mismas dosis estándar tanto para mujeres como para hombres.
Los ciclos hormonales en mujeres fueron considerados como una fuente de sesgos científicos, con lo que convierten la salud femenina en un enigma secundario para la ciencia tradicional. Sin embargo, hoy en día se ha demostrado que ese argumento es falso y el ciclo hormonal no altera la eficiencia de los fármacos en comparación con los hombres. A pesar de esto, no debemos olvidar que el cuerpo femenino metaboliza los fármacos de forma distinta (Figura 2) lo que hace necesario que el desarrollo médico y la dosificación se adapten específicamente a su fisiología.
El primer paso en la farmacocinética es la absorción y distribución del fármaco en el organismo, proceso que se ve afectado por factores fisiológicos como los porcentajes de grasa y músculo, el volumen de agua corporal y el flujo sanguíneo. El sexo biológico juega un papel determinante en esta fase, recordemos que la proporción y distribución del tejido adiposo difiere significativamente entre hombres y mujeres. Mientras que las mujeres presentan en promedio un 21-31% de grasa corporal, los hombres suelen situarse entre un 10-20%. Esto modifica el efecto de los fármacos liposolubles, como las benzodiacepinas (usadas como sedantes y ansiolíticos), que suelen disolverse mejor en la grasa por su composición química [3]. Las mujeres al tener un mayor porcentaje de tejido adiposo pueden llegar a acumular y retener más tiempo estos medicamentos, por lo que aumentan las posibilidades de presentar algún efecto secundario a largo plazo.
Por otro lado, los hombres tienen proporcionalmente más masa muscular que retiene agua, por lo que los fármacos hidrosolubles (aquellos que se disuelven mejor en agua), se diluyen más rápido en su cuerpo, mientras que en las mujeres estos fármacos se acumulan en la sangre.
Un dato curioso que pocos conocen es que el hígado representa una mayor proporción del peso total en las mujeres que en los hombres, además de ser más eficiente para realizar la limpieza de fármacos. Esto significa que es más activo en el cuerpo femenino, lo que permite eliminar ciertos fármacos mucho más rápido que en hombres.
Un ejemplo cotidiano de cómo el hígado puede procesar sustancias de forma distinta, es el metabolismo de ciertos antibióticos, donde el cuerpo femenino elimina más rápido estas sustancias. Sin embargo, aquí ocurre una paradoja: aunque el hígado trabaje más rápido, las mujeres suelen sentir los efectos secundarios de forma más intensa y casi inmediata. ¿Cuál es la causa? La respuesta está nuevamente en la composición del cuerpo. El cuerpo femenino tiene naturalmente un menor porcentaje de agua y algunos fármacos tienen “menos espacio” para diluir, alcanzando concentraciones más altas en la sangre de forma más rápida. Por ello, es importante promover la investigación clínica utilizando cuerpos femeninos como modelos específicos.
Otro ejemplo paradigmático es el zolpidem, un medicamento ampliamente prescrito para el insomnio. En 2013, la FDA reconoció que las mujeres metabolizan este medicamento más lentamente, lo que provoca concentraciones plasmáticas más altas al día siguiente, prolongando el efecto sedante del medicamento y por ende aumentando el riesgo de accidentes automovilísticos y caídas.
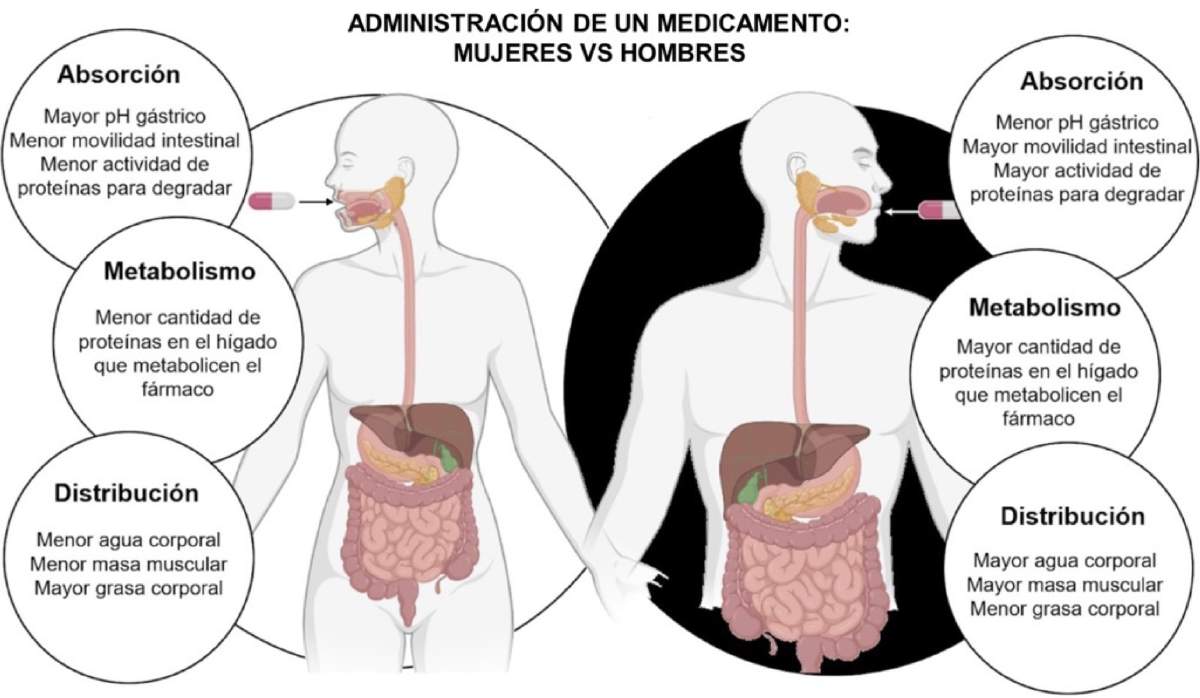
Figura 2. Diferencias fundamentales al tomar un medicamento entre hombres y mujeres [3].
El infarto y enfermedades prevalentes en mujeres
El sexo influye en la frecuencia con la que se presentan algunas enfermedades, por ejemplo, algunos tipos de cáncer pueden afectar principalmente a la población femenina, como los cánceres de mama, tiroides o vesícula [4]. Asimismo, debido a la anatomía del tracto urinario, las mujeres son más propensas a contraer infecciones por hongos o bacterias. Además, son más susceptibles a desarrollar osteoporosis, enfermedades autoinmunes y enfermedades cardiovasculares que los hombres. Aunque cualquier persona puede presentar estas afecciones, el mayor porcentaje de los pacientes son mujeres (Figura 3).
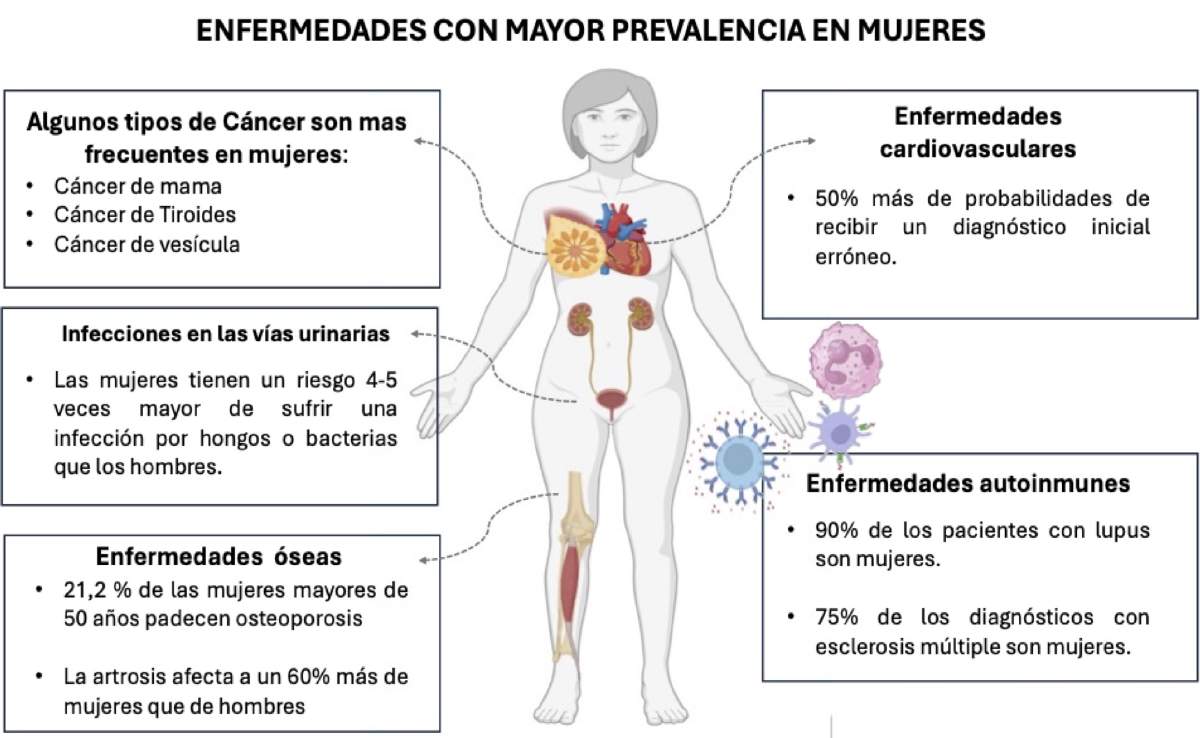
Figura 3. Principales enfermedades con mayor prevalencia en mujeres, basado en datos epidemiológicos y reportes clínicos previos [4, 5].
Pero ¿por qué las enfermedades cardiovasculares son la principal causa de muerte en mujeres a nivel mundial? Sencillo, su descripción clínica clásica se basa en estudios realizados mayoritariamente en hombres.
Un episodio tan frecuente como un infarto cardiaco, suele presentarse como un dolor torácico opresivo en hombres, pero en las mujeres es más común que presenten síntomas diferentes, como fatiga extrema, náuseas o dolor dorsal. Estos síntomas han sido etiquetados durante años como “atípicos”, lo que conduce a diagnósticos tardíos y tratamientos menos agresivos (Figura 4).
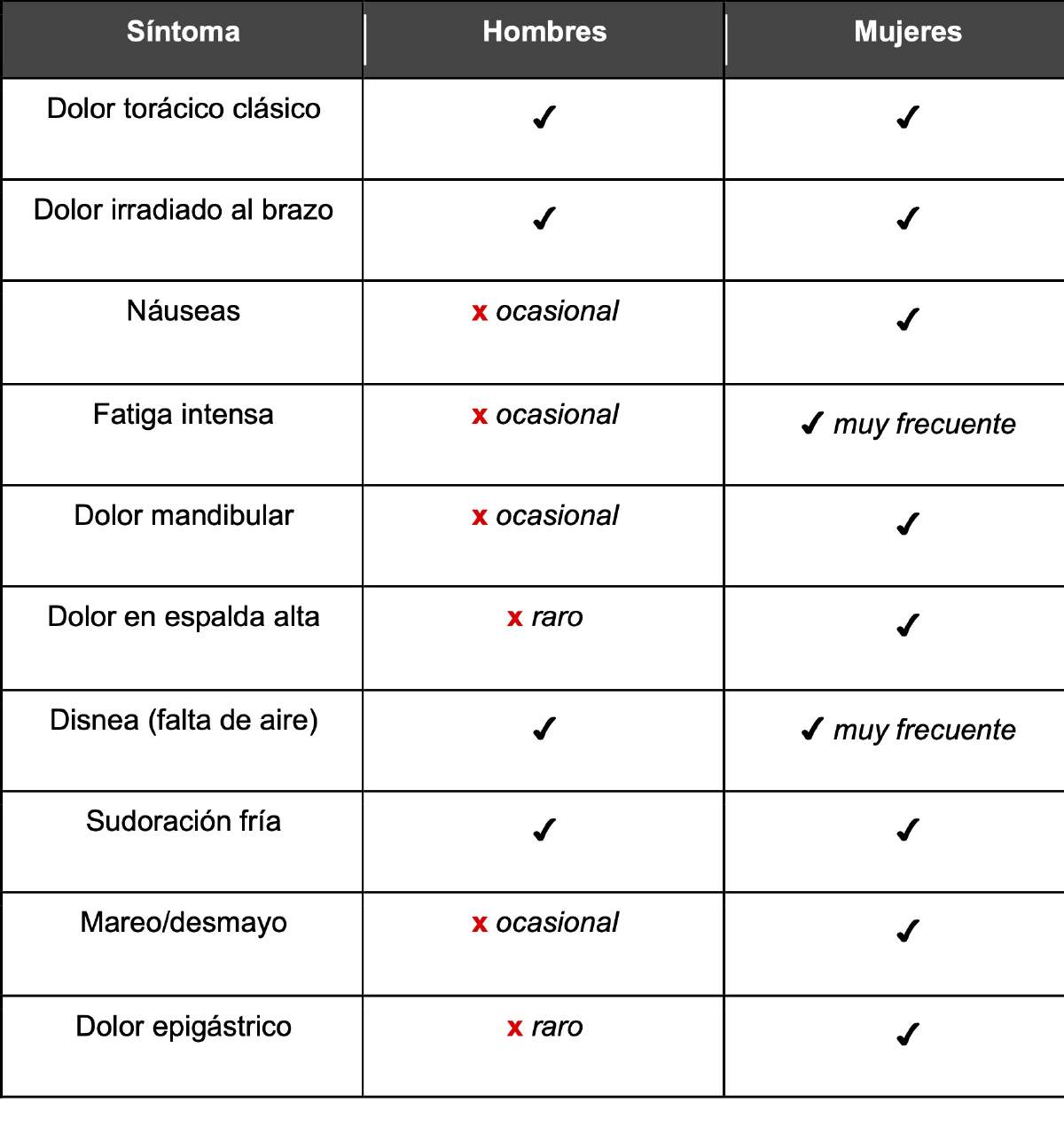
Figura 4. Síntomas de infarto según el género.
Cuando la medicina es más peligrosa para ellas
En análisis generales, las mujeres presentan mayor riesgo de reacciones adversas a medicamentos. De hecho, más del 80% de los fármacos retirados del mercado estadounidense entre 1997 y 2000 mostraban una mayor toxicidad en mujeres [6]. El exceso de reacciones adversas que presentaban las mujeres ante los diversos medicamentos que no eran probados en ellas, provocaba que los medicamentos fueran retirados del mercado al poco tiempo de su lanzamiento. Según el informe de la Oficina de Rendición de Cuentas del Gobierno de Estados Unidos, entre 1997 y 2000 al menos ocho medicamentos fueron retirados del mercado estadounidense por representar un riesgo elevado en las mujeres, aun cuando su uso era similar entre ambos sexos [6].
Este suceso marcó un cambio en la investigación, al dejar en evidencia que no era posible extrapolar lo que sucedía en el cuerpo del hombre promedio, al de una mujer. La falta de consideración de la fisiología femenina en el proceso de desarrollo de medicamentos estaba poniendo vidas en riesgo.
Un doloroso evento histórico que fue resultado directo de la exclusión de las mujeres en la ciencia se desarrolla a finales de la década de 1950 y a principios de los 60. En este periodo la farmacéutica alemana Chemie Grünenthal saca a la venta la talidomida en 46 países. Este era un fármaco recetado para combatir la ansiedad y las náuseas comunes durante el embarazo...pero nunca se probó su seguridad y posibles efectos colaterales en mujeres embarazadas.
En aquella época, se asumió erróneamente que la barrera placentaria era impenetrable y por lo tanto, el feto estaba protegido de cualquier medicamento que era ingerido por la madre, por lo que el uso de medicamentos durante el embarazo no estaba estrictamente controlado. Esta falsa creencia hizo que se incluyeran erróneamente a las mujeres embarazadas de pruebas de citotoxicidad.
El resultado fue el nacimiento de más de 10,000 niños con malformaciones graves (como defectos graves en el desarrollo de las extremidades, ojos, corazón y el tracto urinario). El 40% de estos bebés murieron poco después de su nacimiento y miles de mujeres sufrieron abortos espontáneos.
Estos efectos congénitos de la talidomida llevaron al desarrollo de una mayor regulación y supervisión de los medicamentos en muchos países. Por ejemplo, en Estados Unidos la distribución de la talidomida fue prohibida por la Administración de Alimentos y Medicamentos (FDA), esto impulsó el desarrollo de nuevos protocolos de seguridad para los medicamentos administrados en mujeres embarazadas.
Actualmente, y después de años de investigaciones clínicas, la talidomida ha sido reincorporada en diversos países como una opción terapéutica para enfermedades como la lepra y algunos tipos de cánceres, entre ellos el mieloma múltiple (un tipo de cáncer de la médula ósea). Y debido a sus efectos secundarios, se prescribe bajo programas estrictos como el Sistema para la Educación y la Seguridad en la Prescripción de Talidomida (STEPS, siglas en inglés de System for Thalidomide Education and Prescribing Safety), que piden a los pacientes pruebas de embarazo obligatorias antes de administrar el medicamento y el uso de métodos anticonceptivos durante el tratamiento
Mujeres embarazadas en la pandemia por COVID-19
Aunque se ha considerado de forma constante un tema a debatir, desde 1994 el Instituto de Medicina se ha encargado de promover la no exclusión injustificada de las mujeres embarazadas o lactantes de las pruebas clínicas de medicamentos. Sin embargo, esta labor de promoción no ha logrado impactar a todos, pues en muchas ocasiones aún se les excluye. Esto fue evidente en la pandemia por COVID-19, donde a pesar de que las mujeres embarazadas eran consideradas como una población en alto riesgo, muchos de los tratamientos eficaces que se deseaban emplear carecían de información sobre su seguridad en mujeres embarazadas. Esto afecta también el tratamiento de otras enfermedades, como pasa con el uso de anticuerpos monoclonales como tocilizumab o inmunomoduladores como tacrolimus, mientras que aquellos que sí se sabía que eran seguros no mostraban una mejora significativa ni siquiera en las pacientes que no estaban embarazadas. Esto es una complicación continua para el tratamiento y la búsqueda de medicamentos seguros en este sector de la población, por haber sido excluidas en el pasado de las pruebas clínicas de los medicamentos.
La investigación mexicana actual
Pronto se hizo evidente que la exclusión de las mujeres generaba más problemas de los que originalmente se buscaba evitar. A partir de los años 2000, se incluye en normativas y guías de práctica la recomendación de evitar la exclusión de las mujeres en estos estudios sin una justificación válida. En México la Norma Oficial Mexicana NOM-177-SSA1-2013 [7], determina que, si se usaran sujetos de estudio de un solo sexo, debe existir una justificación de porqué se excluye al otro sexo, como ocurre cuando un medicamento no está destinado para usarse en ambos sexos y, por ende, no requiere de su evaluación.
Estos cambios han sido aplicados incluso a las evaluaciones realizadas en animales. Por ejemplo, las guías de la Organización para la Cooperación y el Desarrollo Económico (OECD) institución que brinda las directrices para las pruebas de productos químicos, ya declara que como mínimo se deben utilizar al menos diez animales, de los cuales cinco deberán ser hembras. Promoviendo también una evaluación más representativa para futuras evaluaciones.
2026, una deuda científica con las mujeres
En 2026, la comunidad científica reconoce la necesidad de integrar de manera sistemática el sexo biológico como una variable fundamental en la investigación médica. Esto nos permite avanzar hacia una medicina basada en evidencia diferenciada por sexo, que no solo mejora la calidad del diagnóstico y del tratamiento, sino que fortalece la validez científica de los estudios y contribuye a una atención sanitaria más segura, personalizada y efectiva para toda la población. Si consumes alguno de los fármacos mencionados o tienes dudas sobre su tratamiento, consulta con un experto en el tema y evita la automedicación.
Referencias
- Beery, A. K., & Zucker, I. (2011). Sex bias in neuroscience and biomedical research. Neuroscience and biobehavioral reviews, 35(3), 565–572. https://doi.org/10.1016/j.neubiorev.2010.07.002
- National Institutes of Health. (2015). Consideration of sex as a biological variable in NIH-funded research. https://grants.nih.gov/grants/guide/notice-files/NOT-OD-15-102.html
- Aljohmani, A., & Yildiz, D. (2025). Biological sex differences in pharmacokinetics and adverse drug reactions. Naunyn-Schmiedeberg's archives of pharmacology, 10.1007/s00210-025-04721-8. Advance online publication. https://doi.org/10.1007/s00210-025-04721-8
- Segal, N. A., Nilges, J. M., & Oo, W. M. (2024). Sex differences in osteoarthritis prevalence, pain perception, physical function and therapeutics. Osteoarthritis and cartilage, 32(9), 1045–1053. https://doi.org/10.1016/j.joca.2024.04.002
- World Health Organization. (2022). Gender and health. https://www.who.int/health-topics/gender
- Government Accountability Office. (2001, January 19). GAO-01-286R - Drug Safety: Most drugs withdrawn in recent years had greater health risks for women [Government report]. U.S. Government Printing Office. https://www.gao.gov/products/gao-01-286r
- Secretaría de Salud. (2013). Norma Oficial Mexicana NOM-177-SSA1-2013. https://www.dof.gob.mx/nota_detalle.php?codigo=5314833&fecha=20/09/2013
Esta columna se prepara y edita semana con semana, en conjunto con investigadores morelenses convencidos del valor del conocimiento científico para el desarrollo social y económico de Morelos.



